 |
Последовательность фракционирования белков сульфатом аммония
|
|
|
|
| Показатель | Шаг | |||||
| 1-й | 2-й | 3-й | 4-й | 5-й | 6-й | |
| Объем 4,5 М (NH4)2SO4, мкл | ||||||
| Исходный объем смеси, мкл | ||||||
| Конечный объем смеси, мкл | ||||||
| Концентрация (NH4)2SO4 в смеси, моль/л: | ||||||
| исходная | 0,0 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 |
| конечная | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 |
3.Центрифугировать 10 мин при 5000g и 4°С. Супернатант
полностью отобрать в чистую микропробирку.
Внимание! Для того чтобы удалить супернатант досуха, в том
числе и кати со стенок пробирки, требуется повторное центрифуги-
рование в течение 5—10 с при 5000g и 4 °С.
4.К осадку прибавить 30 мкл стерильной деионизованной
воды. Ресуспендировать осадок легким встряхиванием пробирки.
Маркировать пробирку с полученной фракцией белков значением
конечной концентрации сульфата аммония (см. табл. 7) и выдержать при 2—8 °С до полногорастворенияосадка(можнооставитьна ночь).
5.К супернатанту прибавить необходимый объем 4,5 М раствора сульфата аммония, как указановыше.Выдержать20минпри4°С.
6.Повторить операции, изложенные в пп. 2—5, еще 4 раза в соответствии с таблицей 9. Последний раз супернатант отбросить.
Полученные фракции белков хранить при температуре 2—8 °С до
2 нед и использовать для последующего электрофоретического
разделения (см. практическую работу № 21).
Контрольные вопросы. 1. Что представляет собой процесс растворения белков?
2. Перечислите аминокислоты, входящие в состав белков, радикалы которых в
водном растворе имеют заряд. Какой именно? 3. Что такое высаливание? 4. Каков
механизм высаливания белков? 5. Перечислите причины, по которым для высали-
вания белков используют именно сульфат аммония. 6. Как влияют ионная сила,
рН и температура раствора на процесс высаливания?
|
|
|
Задания.1. Определить концентрацию сульфата аммония, оптимальную для высаливаниябычьегосывороточногоальбумина.
Можно использовать раствор БСА в воде, приготовленный для
построения калибровочной кривой (200—500 мг/мл). 2. Разработать схему фракционирования белков для высаливания БСА из
смеси белков.
Практическая работа № 17
ДИАЛИЗ БЕЛКОВ
Большинство полимерных материалов, широко использующихся в разных сферах науки и техники, имеют хаотически построенную молекулярную структуру (полиэтилен, полистирол, полиметакрилат и их производные). Полимерные волокна переплетаются и ветвятся настолько плотно, что, несмотря на ячеистость
поверхности образованной ими пленки, задерживают практически все молекулы, за исключением гелия — газа, молекулы которого имеют наименьший размер среди всех химических веществ, химически инертны и потому трудно удерживаемы внутри сосудов
из полимерных материалов. Однако существуют полимеры с регулярной структурой, состоящей практически только из прямолинейно вытянутых макромолекул, ряды которых пересекаются друг с другом под разными углами, образуя строго упорядоченную форму «объемной сетки» (сетчатость становится видимой после
проекции молекулярной структуры на плоскость). Размер ячеек
такой сетки очень мал, но все же значительно больше, чем у мелких молекул, например воды.
Самые распространенные из сетчатых полимеров — целлофан
(нитроцеллюлоза) и нейлон (полиамид-66). Размер ячеек в производимых из них мелкопористых пленках (мембранах) можно регулировать в ходе технологического процесса в очень широких пределах, в соответствии с чем мембраны делят на несколько основных типов:
микрофильтрационные с размером пор 0,2—2,0 мкм задерживают мелкие взвеси и коллоидные частицы, определяемые как мутность;
|
|
|
ультрафильтрационные с размером пор 0,02—0,2 мкм удаляют
крупные органические молекулы (молекулярная масса больше
10 000), коллоидные частицы, бактерии и вирусы, не задерживая
при этом растворенные соли. Именно такие мембраны используют для холодной стерилизации растворов (ультрафильтрации)идиализа макромолекул (белков и нуклеиновых кислот);
нанофилътрационные с размером пор 0,002—0,02 мкм задерживают органические соединения молекулярной массы выше 300 и
пропускают, в зависимости от структуры, от 15 до 90 % солей;
обратноосмотические содержат самые узкие поры и поэтому являются самыми селективными. Они задерживают все бактерии и
вирусы, большую часть растворенных солей и органических веществ. В среднем обратноосмотические мембраны задерживают
97—99 % всех растворенных веществ.
Ультрафильтрацию осуществляют, как правило, под давлени-
ем через мембраны, специально укрепленные в пластиковом кор-
пусе — фильтре, который имеет стандартные крепления для
шприца и иглы (рис. 21).
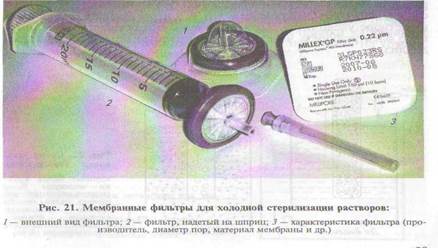
В шприц набирают раствор, подлежащий
ультрафильтрации, на его носик надевают фильтр и с помощью поршня и физической силы продавливают раствор через мембрану. Частицы, размер которых больше пор мембраны, остаются на фильтре и вместе с ним отбрасываются.
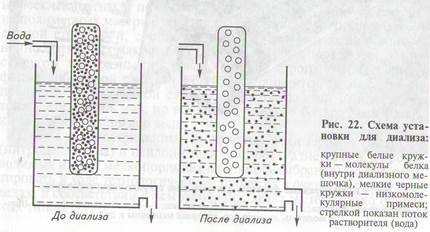
Диализ, в сущности, представляет процесс, обратный фильтра-
ции, — очищают не раствор или растворитель, а растворенное вещество, чаще всего белок (нуклеиновые кислоты легче всего отделить от низкомолекулярных примесей осаждением при помощи этилового или изопропилового спирта). Для этого раствор белка,загрязненный низкомолекулярными примесями (например, солями или органическими молекулами), отделяют от чистого раство
рителя ультрафильтрационной мембраной, через которую растворитель и низкомолекулярные примеси проходят в обоих направлениях, а белок остается по одну сторонуотнее(рис.22).Черезопределенное время концентрация низкомолекулярных примесейвыравнивается по обе стороны мембраны (т. е. в растворе белка
она снижается во столько раз, во сколько объем этого раствора
меньше по отношению к растворителю). Если при этом растворитель еще и заменяется на свежий(периодическиилинепрерывно),концентрация примесей в растворе белка снизится практически до нуля.
|
|
|
Диализ можно совместить с ультрафильтрацией, производя его
при повышенном гидростатическом давлении над раствором белка (или пониженном над растворителем), образующимся, например, из-за перепада уровней жидкости. В таких условияхобъемраствора белка будет уменьшаться при неизменном количестве ра-
створенных в нем макромолекул, т. е. в итоге концентрация белка
в растворе увеличится. То же самое можно осуществить с помощью электрофореза через полупроницаемуюмембрану(электро-диализ).
Тем не менее основное практическое значение метода состоит
все-таки в возможности очистки от примесей, в частности от свободных аминокислот и низкомолекулярных пептидов, завышающих показатель концентрации белка, определенный методом Лоури. Кроме того, диализовать белки необходимо после препаративного изоэлектрофокусирования для того, чтобы удалить амфолиты, мешающие довести рН раствора белка до требуемого
(например, рН-оптимума определенного фермента), а также после
преципитации сульфатом аммония для удаления из белка избытка
соли и повышения его растворимости.
Цель работы. Ознакомиться с методом диализа белков. Очистить полученные ранее препараты белков от низкомолекулярных примесей.
Оборудование и материалы. 1. Трубки стеклянные диаметром 6—8 мм (можно
использовать трубки от прибора для вертикального электрофореза в ПААГ, см.
практическую работу № 21). 2. Целлофановая пленка. 3. Капроновая нить.
4. Швейная игла (или игла для шприца). 5. Пенопласт (или пенополиэтилен) в
пластинках толщиной 0,5—1 см. 6. Пробковое сверло под диаметр используемых
стеклянных трубок. 7. Фильтровальная бумага. 8. Стакан стеклянный вместимостью до 1 л. 9. Дозаторы автоматическиепеременногообъемаснаконечниками.10. Препарат белка, требующий диализа (можно использовать пробы,полученные после изоэлектрофокусирования или высаливания белков). 11. Бидистиллированная (иди деионизованная) вода.
Ход работы. Приготовление установки для диализа. 1. Изготовление диализного мешочка. 1.1. Нарезать из целлофана кружки диаметром около 4 см. 1.2. Обернуть кружком стеклянную трубку и привязать края целлофановой пленки капроновой
нитью к трубке так, чтоб пленка оказалась натянутой на трубку,
полностью закрывая ее торец (рис. 23).
|
|
|
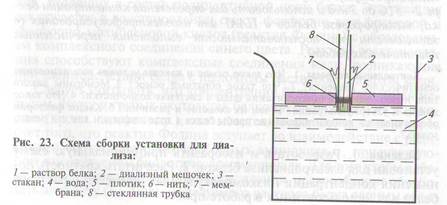
Внимание! Будьте осторожны — не порвите целлофановую пленку!
2.Изготовление плотика. В пластинке из пенопласта просверлить отверстия по числу трубок с мембранами и воткнуть в них
трубки так, чтобы концы трубок с пленкой выступали наружу
примерно на 2—4 мм.
3.Сборка диализной установки. В стакан налить заранее охлажденную до 2—8°С бидистиллированную воду и опустить в него
плотик, чтобы он свободно плавал на поверхности воды. Не допускать образования пузырьков воздуха на мембране, соприкасающейся с
водой! Выдержать установку при 2—8 °С 5—10 мин.
Проведение диализа. 1. В диализные мешочки внести
20—200 мкл пробы белка с помощью автоматического дозатора
так, чтобы жидкость стекла вниз к мембране. Не допускать образо-
вания пузырьков воздуха на мембране или стенках мешочка! При
этом уровень жидкости в мешочке должен быть на 2—5 мм больше, чем расстояние, на которое конец трубки с мембраной выступает наружу из плотика (см. рис. 23). При необходимости отрегулировать положение мешочка в плотике, двигая трубку вверх-
вниз.
2.Диализ провести при 2—8 °С в течение 2—3 ч (по возможности при слабом перемешивании воды в стакане на магнитной мешалке), затем заменить воду в стакане и оставить в тех же условиях на ночь.
3.Извлечь плотик и, не разбирая его и не прикасаясь руками к
мембране, осторожно удалить капли с наружной поверхности
мембраны фильтровальной бумагой.
4.Осторожно проколоть мембрану швейной иглой. В образовавшееся отверстие вставить кончик наконечника автоматического дозатора и отобрать пробу из диализногомешочкавчистуюмикропробирку. Полученные пробы можно хранить при температуре 2—8 "С до 3 нед и использовать для определения концентрации бел-
ка, электрофореза белков в ПЛАТ или изоэлектрофокусирования (в
зависимости от последовательности выполнения перечисленных
практических работ).
Контрольные вопросы. 1. Что такое осмос и каковы условия возникновения
осмотического давления? 2. Что такое обратный осмос? 3. Мембраны какого
типа используют для обессоливания воды в системах водоочистки? 4. Что такое
диализ и ультрафильтрация? В чем их сходство и различие? 5. Каким фактором
обеспечивается концентрирование пробы белка в ходе диализа и как его реализовать?
Задания.1.Разработатьиизобразитьпринципиальнуюсхемуустановки для электродиализа белков. 2. Рассчитать кратность понижения концентрации низкомолекулярных примесейврастворебелка для использованных в работе проб.
|
|
|
Практическая работа № 18
|
|
|


