 |
Кислородсодержащие соединения
|
|
|
|
⇐ ПредыдущаяСтр 43 из 43
| Вещество |  , , 
|  , ,

|  , ,

|  , ,

| Коэффициенты уравнения 
| Температурный интервал, К | |||
| а | b ×103 | с ×106 | |||||||
| CH2O (г.) формальдегид!!! | –115,90 | 218,78 | –109,94 | 35,39 | 18,82 | 58,38 | –15,61 | 298–1500 | |
| СН2О2 (ж.) муравьиная кислота!!! | –424,76 | 128,95 | –361,74 | 99,04 | – | – | – | – | |
| CH2O2 (г.) муравьиная кислота!!! | –378,80 | 248,77 | –351,51 | 45,80 | 19,40 | 112,80 | –47,50 | 298–1000 | |
| CH2O2 (ж.) муравьиная кислота!!! | –424,72 | 128,95 | –361,35 | 99,04 | |||||
| СН4O (ж.) метанол!!! | –238,57 | 126,78 | –166,27 | 81,60 | – | – | – | – | |
| СН4O (г.) метанол!!! | –201,00 | 239,76 | –162,38 | 44,13 | 15,28 | 105,20 | –31,04 | 298–1000 | |
| С2Н4O (г.) ацетальдегид!!! | –166,00 | 264,20 | –132,95 | 54,64 | 13,00 | 153,50 | –53,70 | 298–1000 | |
| С2Н4O (г.) этиленоксид | –52,63 | 242,42 | –13,09 | 48,50 | –2,02 | 190,60 | –73,60 | 298–1000 | |
| С2Н4O2 (ж.) уксусная кислота!!! | –484,09 | 159,83 | –389,36 | 123,43 | – | – | – | – | |
| C2H4O2 (г.) уксусная кислота!!! | –434,84 | 282,50 | –376,68 | 66,50 | 14,82 | 196,70 | –77,70 | 298–1000 | |
 (aq.) ацетатный ион!!! (aq.) ацетатный ион!!!
| –486,01 | 86,6 | –369,31 | –6,3 | |||||
| C2H6O (ж.) этанол!!! | –276,98 | 160,67 | –174,15 | 111,96 | – | – | – | – | |
| C2H6O (г.) этанол!!! | –234,80 | 281,38 | –167,96 | 65,75 | 10,99 | 204,70 | –74,20 | 298–1000 | |
| C2H6O (г.) диметиловый эфир!!! | –184,05 | 267,06 | –112,94 | 65,81 | 16,18 | 183,90 | –58,70 | 298–1000 | |
| Вещество |  , , 
|  , ,

|  , ,

|  , ,

| Коэффициенты уравнения 
| Температурный интервал, К | |||
| а | b ×103 | с ×106 | |||||||
| С3Н6О (ж.) ацетон!!! | –248,11 | 200,41 | –155,42 | 125,00 | – | – | – | – | |
| С3Н6О (г.) ацетон!!! | –217,57 | 294,93 | –153,05 | 74,90 | 22,47 | 201,80 | –63,50 | 298–1500 | |
| С4Н8О2 (ж.) этилацетат!!! | –479,03 | 259,41 | –332,74 | 169,87 | – | – | – | – | |
| С6Н6О (кр.) фенол!!! | –164,85 | 144,01 | –50,21 | 134,70 | – | – | – | – | |
| С6Н12О6 (кр.) a-D-глюкоза!!! | –1274,45 | 212,13 | –910,56 | 218,87 | |||||
| С6Н12О6 (кр.) b-D-глюкоза!!! | –1268,05 | 228,03 | –908,89 | ||||||
| С7Н6О2 (кр.) бензойная кислота!!! | –385,14 | 167,57 | –245,24 | 145,18 | – | – | – | – | |
| С12Н22О11 (кр.) сахароза!!! | –2222,12 | 360,24 | –1544,70 | 425,00 | – | – | – | – | |
|
|
|
Галогенсодержащие соединения
| СНСl3 (ж.) трихлорметан (хлороформ)!!! | –132,21 | 202,92 | –71,85 | 116,30 | – | – | – | – |
| СНСl3 (г.) трихлорметан (хлороформ)!!! | –101,25 | 295,64 | –68,52 | 65,73 | 29,50 | 148,90 | –90,70 | 298–773 |
| С2Н5Сl (г.) хлорэтан!!! | –111,72 | 275,85 | –60,04 | 62,72 | 11,63 | 193,00 | –72,92 | 298–1000 |
Азотсодержащие соединения
| Вещество |  , , 
|  , ,

|  , ,

|  , ,

| Коэффициенты уравнения 
| Температурный интервал, К | ||
| а | b ×103 | с ×106 | ||||||
| CH4N2O (кр.) карбамид (мочевина)!!! | –333,17 | 104,60 | –197,15 | 93,14 | – | – | – | – |
| CH5N (г.) метиламин!!! | –23,01 | 242,59 | 32,18 | 50,08 | 14,70 | 132,60 | –41,08 | 298–1000 |
| C6H5NO2 (ж.) нитробензол!!! | 15,90 | 224,26 | 146,20 | (186) | – | – | – | – |
| C6H7N (ж.) анилин!!! | 31,09 | 191,29 | 149,08 | 190,79 | – | – | – | – |
| C6H7N (г.) анилин!!! | 86,86 | 319,20 | 166,67 | 108,40 | –6,00 | 439,40 | –185,30 | 298–1000 |
| С9Н9O4N(ж) этиловый эфир нитробензойной кислоты C2H5O–CO–C6H4NO2!!! | –463,2 | |||||||
| С9Н11O2N(ж) этиловый эфир аминобензойной кислоты C2H5O–CO–C6H4NH2!!! | –1759,0 |
10. Теплота сгорания питательных веществ
в живом организме и в калориметре
| Вещество | D Н с в организме, ккал/г | D Н с в калориметре, ккал/г |
| Углеводы | –4,1 | –4,1 |
| Жиры | –9,3 | –9,3 |
| Белки (организме окисляются не полностью – до мочевины) | –4,1 | –5,7 |
Криоскопические и эбуллиоскопические константы
| Растворитель | K кр | K эб |
| Вода | 1,86 | 0,514 |
| Уксусная кислота | 3,90 | 2,93 |
| Бензол | 5,12 | 2,64 |
| Нафталин | 6,8 | 5,65 |
| Фенол | 7,27 | 3,04 |
| CCl4 | 4,95 | |
| Камфора | 39,8 | 6,09 |
| Этанол | 1,15 | |
| Диэтиловый эфир | 1,79 | 2,02 |
| Хлороформ | 4,9 | 3,88 |
| Анилин | 5,87 | 3,22 |
| Ацетон | 2,4 | 1,48 |
| Нитробензол | 6,90 | 5,27 |
Удельная электрическая проводимость растворов KCl
| с KCl, М | k, См/м, при температуре, °С | ||||||
| 0,01 | 0,0776 | 0,0896 | 0,1020 | 0,1147 | 0,1278 | 0,1413 | 0,1552 |
| 0,02 | 0,1521 | 0,1752 | 0,1994 | 0,2243 | 0,2501 | 0,2765 | 0,3036 |
| 0,1 | 0,715 | 0,822 | 0,933 | 1,048 | 1,167 | 1,288 | 1,412 |
| 1,0 | 6,541 | 7,414 | 8,319 | 9,252 | 10,207 | 11,180 | – |
13. Предельные молярные подвижности ионов в водном растворе при 25°С
|
|
|
| Катионы |  , Ом–1×см2×моль–1 , Ом–1×см2×моль–1
| Анионы |  , Ом–1×см2×моль–1 , Ом–1×см2×моль–1
|
| Н+ | 349,8 | Br– | 78,14 |
| Li+ | 36,68 | I– | 78,84 |
| Na+ | 50,10 | ClO4– | 67,36 |
| K+ | 73,50 | NO3– | 71,46 |
| Rb+ | 77,81 | NO2– | 72,0 |
| Ag+ | 61,90 | 1/2CO32– | 69,3 |
| NH4+ | 73,55 | 1/2SO42– | 79,8 |
| CH3NH3+ | 58,7 | HCOO– | 54,6 |
| (CH3)2NH2+ | 51,9 | CH3COO– | 40,9 |
| (CH3)3NH+ | 47,25 | C2H5COO– | 35,8 |
| (CH3)4N+ | 44,92 | C3H7COO– | 32,6 |
| 1/2Mg2+ | 53,05 | C4H9COO– | 28,8 |
| 1/2Ca2+ | 59,50 | C6H5COO– | 35,8 |
| 1/2Ba2+ | 63,63 | CH2ClCOO– | 39,8 |
| OH– | 198,3 | CHCl2COO– | 38,3 |
| F– | 55,4 | CCl3COO– | 36,6 |
| Cl– | 76,35 | CH2CNCOO– | 39,8 |
14. Молярная электропроводность разбавленных водных растворов электролитов при 25°С
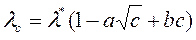
lс – молярная электропроводность, См·м2/моль;
с – концентрация, моль/л.
Коэффициенты l*, a, b применимы в области концентраций 0,001 – 0,1 моль/л.
| Электролит | l* ×104 | a | b |
| HCl | 426,0 | 0,37 | 0,38 |
| HBr | 429,4 | 0,37 | 0,35 |
| HI | 0,37 | 0,42 | |
| KCl | 149,8 | 0,63 | 0,64 |
| KBr | 151,7 | 0,62 | 0,62 |
| KI | 150,8 | 0,63 | 0,62 |
| KNO3 | 144,5 | 0,64 | 0,36 |
| KOH | 0,45 | 0,4 | |
| 1/2K2SO4 | 151,4 | 1,24 | 1,14 |
| NaCl | 126,5 | 0,70 | 0,74 |
| NaBr | 126,0 | 0,70 | 0,5 |
| NaI | 127,0 | 0,70 | 0,80 |
| NaOH | 246,5 | 0,47 | 0,3 |
| 1/2Na2SO4 | 129,0 | 1,39 | 1,50 |
15. Константы диссоциации слабых кислот при 25°С
| Кислота | Формула | Kа, моль/л | р Kа |
| Азотистая | HNO2 | 6,9·10–4 | 3,16 |
| Аскорбиновая | C6H8O6 | K 1 = 9,1·10–5 K 2 = 4,6·10–12 | 4,04 11,34 |
| Бензойная | C6H5COOH | 6,3·10–5 | 4,20 |
| Винная | C4H6O6 | K 1 = 1,3·10–3 K 2 = 3,0·10–5 | 2,89 4,52 |
| Гемоглобин | HHb | 6,31·10–9 | 8,20 |
| Глицериновая | C3H6O4 | 3,0·10–4 | 3,52 |
| Глюконовая | C6H12O7 | 1,4·10–4 | 3,86 |
| Молочная | C3H6O3 | 1,37·10–4 | 3,863 |
| Муравьиная | HCOOH | 1,772·10–4 | 3,752 |
| Оксигемоглобин | HHbO2 | 2,12·10–7 | 6,95 |
| Пероксид водорода | H2O2 | 2,0·10–12 | 11,7 |
| Серная | H2SO4 | K 2 = 1,15·10–2 | 1,94 |
| Сероводородная | H2S | K 1 = 1,0·10–7 K 2 = 2,5·10–13 | 6,99 12,60 |
| Уксусная | CH3COOH | 1,754·10–5 | 4,756 |
| Фенол | C6H5OH | 1,01·10–10 | 9,998 |
| Фосфорная (ортофосфорная) | H3PO4 | K 1 = 7,11·10–3 K 2 = 6,34·10–8 K 3 = 1,26·10–12 | 2,148 7,198 11,90 |
| Фтороводородная | HF | 6,2·10–4 | 3,21 |
| Щавелевая | H2C2O4 | K 1 = 6,5·10–2 K 2 = 5,18·10–5 | 1,187 4,296 |
16. Константы диссоциации слабых оснований при 25°С
| Основание | Формула | Kb, моль/л | p Kb |
| Гидроксид аммония | NH4OH | 1,77·10–5 | 4,752 |
| Метиламин | CH3NH2 | 4,24·10–4 | 3,373 |
| Этиламин | C2H5NH2 | 3,18·10–4 | 3,498 |
| Пропиламин | C3H7NH2 | 5,62·10–4 | 3,256 |
| Бутиламин | C4H9NH2 | 4,57·10–4 | 3,340 |
| Диметиламин | (CH3)2NH | 6·10–4 | 3,222 |
| Триметиламин | (CH3)3N | 6,31·10–5 | 4,200 |
| Диэтиламин | (C2H5)2NH | 9,6·10–4 | 3,018 |
| Анилин | C6H5NH2 | 3,82·10–10 | 9,418 |
| Бензиламин | C6H5CH2NH2 | 2,35·10–5 | 4,629 |
| Гидразин | N2H4 | 1,7·10–6 | 5,77 |
| Пиперидин | C5H11NH | 1,32·10–3 | 2,879 |
| Пиридин | C5H5N | 1,71·10–9 | 8,767 |
|
|
|
17. Стандартные электродные потенциалы при 25°С
| Электрод | Электродная реакция | Е °, В |
| Li+ / Li | Li+ + e = Li | – 3,045 |
| K+ / K | K+ + e = K | – 2,925 |
| Ba2+ / Ba | Ba2+ + 2 e = Ba | – 2,906 |
| Ca2+ / Ca | Ca2+ + 2 e = Ca | – 2,866 |
| Na+ / Na | Na+ + e = Na | – 2,714 |
| Mg2+ / Mg | Mg2+ + 2 e = Mg | – 2,363 |
| Mn2+ / Mn | Mn2+ + 2 e = Mn | – 1,180 |
| Se / Se2– | Se + 2 e = Se2– | – 0,77 |
| Zn2+ / Zn | Zn2+ + 2 e = Zn | – 0,763 |
| S / S2– | S + 2 e = S2– | – 0,51 |
| Fe2+ / Fe | Fe2+ + 2 e = Fe | – 0,440 |
| Cr3+, Cr2+ / Pt | Cr3+ + e = Cr2+ | – 0,408 |
| Cd2+ / Cd | Cd2+ + 2 e = Cd | – 0,403 |
| Co2+ / Co | Co2+ + 2 e = Co | – 0,277 |
| Ni2+ / Ni | Ni2+ + 2 e = Ni | – 0,250 |
| Sn2+ / Sn | Sn2+ + 2 e = Sn | – 0,136 |
| Pb2+ / Pb | Pb2+ + 2 e = Pb | – 0,126 |
| H+ / H2, Pt | H+ + e = 1/2H2 | 0,000 |
| Sn4+, Sn2+ / Pt | Sn4+ + 2 e = Sn2+ | + 0,15 |
| Cl– / AgCl / Ag | AgCl + e = Ag+Cl– | + 0,222 |
| Cl– / Hg2Cl2 / Hg | Hg2Cl2 + 2 e = 2Hg+2Cl– | + 0,268 |
| Cu2+ / Cu | Cu2+ + 2 e = Cu | + 0,337 |
| Cu+ / Cu | Cu+ + e = Cu | + 0,521 |
| I2 / I–, Pt | I2 + 2 e = 2I– | + 0,536 |
| MnO4–, MnO42– /Pt | MnO4– + e = MnO42– | + 0,564 |
| MnO4–, MnO2 /Pt | MnO4– +2H2O + 3 e = MnO2 + 4OH– | +0,60 |
| C6H4O2,C6H4(OH)2,H+ | Pt | C6H4O2 + 2H+ + 2 е = C6H4(OH)2 | + 0,699 |
| Fe3+, Fe2+ / Pt | Fe3+ + e = Fe2+ | + 0,771 |
| Ag+ / Ag | Ag+ + e = Ag | + 0,799 |
| Hg2+ / Hg | Hg2+ + 2 e = Hg | + 0,854 |
| Hg2+, Hg+ / Pt | Hg2+ + e = Hg+ | + 0,91 |
| Br2 / Br–, Pt | Br2 + 2 e = 2Br– | + 1,065 |
| Pt2+ / Pt | Pt2+ + 2 e = Pt | + 1,2 |
| MnO2 / Mn2+, H+, Pt | MnO2 + 4H+ + 2 e = Mn2+ + 2H2O | + 1,23 |
| Cl2 / Cl–, Pt | Cl2 + 2 e = 2Cl– | + 1,360 |
| MnO4–, H+/ Mn2+, Pt | MnO4– + 8H+ + 5 е = Mn2+ + 4H2O | + 1,51 |
| MnO4–, H+ / MnO2, Pt | MnO4– + 4H+ + 3 е = MnO2 + 2H2O | + 1,695 |
| H2 / H–, Pt | H2 + 2 e = 2H– | + 2,2 |
| F2 / F–, Pt | F2 + 2 e = 2F– | + 2,87 |
|
|
|
Воспользуйтесь поиском по сайту:

©2015 - 2026 megalektsii.ru Все авторские права принадлежат авторам лекционных материалов. Обратная связь с нами...

