 |
Основной закон светопоглощения (закон Бугера – Ламберта – Бера)
|
|
|
|
Лекция 14
МОЛЕКУЛЯРНЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
1. Спектрофотометрия.
2.. ИК-спектроскопия.
3. Люминесцентный анализ.
Спектрофотометрия
Спектрофотометрический метод относится к молекулярным абсорбционным методам. Молекулярная абсорбционная спектроскопия основана на поглощении электромагнитного излучения веществами. В зависимости от энергии поглощаемых фотонов различают абсорбционную спектроскопию в видимой, ультрафиолетовой, инфракрасной, микроволновой, рентгеновской областях. Спектроскопию в видимой и УФ-областях традиционно называют спектрофотометрией. Энергия фотонов в этих областях спектра достаточна для переходов электронов в молекуле с одного энергетического уровня на другой.
Молекулы состоят из двух и более атомов, соединенных между собой в определенном порядке химическими связями, образующимися при взаимодействии внешних электронов. При этом атомы сближаются, но так, что их завершенные оболочки не соприкасаются. Энергетическое строение молекулы сложнее, чем у атома. Наряду с движением электронов происходит колебательное движение самих атомов, вернее их ядер, и вращение молекулы как целого. Поэтому в любом стационарном состоянии энергия молекулы складывается из электронной, колебательной и вращательной энергий:
Е = Еэл + Екол + Евр.
Наибольший вклад в полную энергию вносит энергия электронов, наименьший – энергия вращения молекулы:
Еэл >> Екол >> Евр.
Вращение молекул проявляется у веществ лишь в газообразном состоянии, в конденсированных состояниях (жидком и твердом) вращение затруднено.
Так же как и атом, молекула может существовать только в определенных энергетических состояниях, называемых энергетические уровни. Каждому электронному состоянию отвечают колебательные уровни, а каждому колебательному уровню – вращательные (рис. 17.1).
|
|
|
 Рис. 17.1. Схема энергетических уровней молекулы в основном (I) и первом возбужденном (II) электронных состояниях
Рис. 17.1. Схема энергетических уровней молекулы в основном (I) и первом возбужденном (II) электронных состояниях
Основному электронному состоянию (I) отвечает система колебательных уровней, характеризуемая колебательными квантовыми числами V = 0, 1, 2,…. Возбужденное электронное состояние (II) обладает системой колебательных уровней с квантовыми числами V´ = 0, 1, 2, …. У каждого колебательного состояния есть система вращательных уровней, энергия которых пропорциональна вращательному квантовому числу j.
При обычных условиях большинство молекул находится в основном электронном и основном колебательном состояниях. Переходы νвр в этих условиях (рис. 17.1) характеризуют чисто вращательные спектры, линии которых появляются в самой далекой длинноволновой части ИК-спектра и в области микроволн.
Чисто колебательные переходы νкол (рис. 17.1) происходят при неизменном электронном состоянии молекулы. В случае разреженных газов наблюдается колебательно-вращательные спектры молекул νкол + νвр, характеризующие переходы между вращательными уровнями различных колебательных состояний.
Электронные переходы являются наиболее сложными в связи с наложением колебательных, а при определенных условиях и вращательных переходов. Наложение большого числа колебательных переходов часто приводит к существенному уширению полос электронных спектров.
В соответствии с положениями метода молекулярных орбиталей электроны в молекуле могут находится на связывающих, несвязывающих и разрыхляющих орбиталях. Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн. Схема относительного расположения энергетических уровней, соответствующих разнвм молекулярным орбиталям, показана на рис. 17.2.
|
|
|
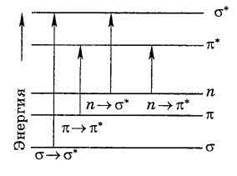
Рис. 17.2. Схема электронных уровней и энергия возможных электронных переходов
Наибольшей энергии требует σ →σ* – переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области (λ ≤ 200 нм). Такие переходы характерны, например, для метана, этана и других насыщенных углеводородов. Переход n→σ* связан уже с меньшими затратами энергии. Полосы, вызванные этим переходом, расположены в обычном (невакуумном) ультрафиолете (λ = 200 – 300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие π*-орбитали. Переходы n→π* и π→π* встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Этими же переходами можно объяснить, например, интенсивную окраску ионов MnO4–, CrO42– (переход с несвязывающей орбитали кислорода).
Типы соединений, применяемых в спектрофотометрическом анализе:
1. Однороднолигандные комплексы с неорганическими лигандами:
– роданидные и галогенидные комплексы (определение Fe(III), Mo, W, Bi, Re, Co);
– аммиакаты (определение Cu2+);
– комплексы металлов с пероксидом водорода (определение Ti, V, Nb, Ta, Ce);
– гетерополикислоты (определение P, Si, As, Nb, V, Ge).
2. Однороднолигандные хелатные комплексы:
– соединения металлов с полифенолами и оксикислотами (Fe3+, Ti, Nb, Ta);
– соединения металлов с органическими красителями типа ализарин (Al, РЗЭ, Zr, Hf);
– соединения металлов с органическими реактивами, содержащими аминный азот (Hg, Al, Mg, Co);
– соединения металлов с органическими реагентами, содержащими нитро - и нитрозогруппы (Co, K, Fe3+);
– соединения металлов с органическими реагентами, содержащими тионную - и тиольную группы (определение Hg, Ag, Pb, Cd, Cu, Bi, Sn, Sb, Zn, As, Fe, Ni, Co).
3. Разнолигандные и разнометальные комплексы. К этой группе отнесены также ионные ассоциаты, которые близки к ней, но отличаются по природе химической связи.
4. Окрашенные соединения, получаемые при реакциях окисления – восстановления (определение Mn, Cr, Ni, As, Se, Te).
5. Малорастворимые соединения и соединения адсорбционного характера (определение NH4+, Mg2+, Na+, Sb3+).
|
|
|
6. Органические соединения, получаемые при реакциях синтеза с участием неорганических веществ (определение NH4+, NO2–, NO3–).
7. Аква-ионы и другие простые соединения, обладающие собственным поглощением (определение Fe3+, Ni, Co, Cu, Cr, оксидов азота и др. по собственному поглощению).
8. Кислотно-основные индикаторы (определение рН).
Количественно поглощение системой излучения описывается законами Бугера – Ламберта – Бера и аддитивности.
Основной закон светопоглощения (закон Бугера – Ламберта – Бера)
Закон связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя.

Рис. 17.3. Прохождение света через окрашенный раствор и растворитель
Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивность света, прошедший через исследуемый раствор и растворитель (рис. 17.3).
Уменьшение интенсивности света, прошедшего через раствор, характеризуется коэффициентом пропускания (или просто пропусканием) Т:
 ,
,
где I и I0 – соответственно интенсивности света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм Т называется оптической плотностью А:

Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера – Ламберта – Бера:
 ,
,
или  ,
,
или A = εlc,
где ε – молярный коэффициент поглощения; l – толщина светопоглощающего слоя; с – концентрация раствора.
Физический смысл ε становится ясным, если принять l = 1см и с = 1 моль/л, тогда А = ε. Следовательно, молярный коэффициент поглощения равен оптической плотности одномолярного раствора при толщине слоя 1 см и имеет смысл чувствительности определения.
Закон аддитивности:
поглощение света каким-либо веществом не зависит от присутствия в растворе других веществ. При наличии в растворе нескольких окрашенных веществ каждое из них будет давать свой аддитивный вклад в экспериментально определяемую оптическую плотность А:
А = А1 + А2 +….+ Ак.
Ограничения и условия применимости закона Бугера – Ламберта – Бера:
|
|
|
1. Закон справедлив для монохроматического света. Чтобы подчеркнуть это ограничение, в выражение закона вводят индексы:
 .
.
2. Коэффициент ε зависит от показателя преломления среды. Изменение показателя преломления в высококонцентрированных растворах может явиться причиной отклонений от основного закона светопоглощения.
3. Температура при измерениях должна оставаться постоянной хотя бы в пределах нескольких градусов.
4. Пучок света должен быть параллельным.
5. Прямолинейная зависимость оптической плотности от концентрации соблюдается только для систем, в которых светопоглощающими центрами являются частицы лишь одного сорта. Например, при разбавлении раствора дихромата калия происходит не просто уменьшение концентрации иона дихромата, а протекают процессы химического взаимодействия:
Cr2O72– + H2O = 2HCrO4– = 2CrO42– + 2H+.
Вместо дихромат-ионов в растворе появляются гидрохромат- и хромат-ионы. Так как  и
и  различны, зависимость оптической плотности от общей концентрации хрома в растворе не будет линейной.
различны, зависимость оптической плотности от общей концентрации хрома в растворе не будет линейной.
6. Интенсивность рассеянного света, возникающего в оптической системе прибора, должна быть сведена до минимума за счет ограничений при изменении ширины щели в разных участках спектра.
Аппаратура для спектрофотометрического метода представлена на рис. 17.4.
 Рис. 17.4. Блок-схема прибора для спектрофотометрического метода анализа
Рис. 17.4. Блок-схема прибора для спектрофотометрического метода анализа
Приведенные на рис.17.4 основные узлы и блоки типичны и обязательны для приборов, используемых для измерения поглощения света; в зависимости от исследуемой области спектра используют разные источники, монохроматоры и детекторы. Материал, из которого изготовлены оптические детали, не должен поглощать излучение в исследуемой области спектра, т.е. должен быть прозрачным.
Источники излучения
Источником является вольфрамовая лампа накаливания. Светящаяся вольфрамовая спираль испускает свет в широком спектральном интервале 350 – 1000 нм. В УФ области интенсивность лампы накаливания мала, поэтому здесь применяют водородные, дейтериевые, ксеноновые лампы. Это газоразрядные трубки, представляющие собой баллоны из кварца, заполненные газом под высоким (несколько атмосфер) давлением. В результате электроразряда молекулы газа возбуждаются (частично диссоциируют) и возвращаются в исходное состояние, испуская непрерывный спектр.
Для калибровки спектрофотометров и при определении однотипных органических соединений, поглощающих в УФ-области, используют ртутную лампу (кварцевый баллон с парами ртути). Возбужденные атомы ртути испускают линейчатый спектр, в котором преобладает излучение с λ = 254, 302, 334 нм.
|
|
|
Монохроматоры
В фотоэлектроколориметрах для выделения нужной длины волны из непрерывного спектра источника используют светофильтры, а в спектрофотометрах – призмы и дифракционные решетки.
Кюветы
В спектрофотометрии измеряют не абсолютное значение оптической плотности, а разность оптических плотностей исследуемого раствора и раствора сравнения, оптическая плотность которого принята за нуль. Кювету с исследуемым раствором называют рабочей, а с раствором сравнения – кюветой сравнения. Основное требование к кюветам – прозрачность. Для работы в видимой области кюветы изготавливают из стекла, а в ультрафиолетовой – из кварца.
Детекторы
Для приема сигнала в видимой и УФ-областях применяют сурьмяно-цезиевый (180-650 нм) и кислородно-цезиевый (600-1100 нм) фотоэлементы, а также фотоэлектроумножители.
|
|
|


