 |
Применение ИК-спектроскопии
|
|
|
|
ИК-спектроскопия остается непревзойденным методом идентификации и исследования строения органических и некоторых неорганических соединений. По ИК-спектрам можно судить о составе сложных смесей органических веществ. Так, метод широко применяют при исследовании органических компонентов почв, из которых большую часть составляют гумусовые кислоты – азотсодержащие оксикарбоновые кислоты.
ИК-излучение подчиняется законам светопоглощения, что можно использовать для количественного определения веществ, обычно применяют метод градуировочного графика. При получении значения Т, особенно для смеси веществ, часто пользуются методом базисной линии, поскольку фон в ИК-области может быть достаточно высоким.
Люминесцентный анализ
Люминесцентный метод анализа основан на измерении интенсивности свечения атомов, ионов, молекул и других более сложных частиц при их возбуждении различными видами энергии, чаще всего квантами УФ- и видимого излучения.
В зависимости от способа возбуждения частиц различают:
| Способ возбуждения | Вид люминесценции |
| Электромагнитное излучение (УФ, видимый свет) | Фотолюминесценция |
| Энергия химических реакций | Хемилюминесценция |
| Энергия химических реакций, протекающих в живых организмах | Биолюминесценция |
| Рентгеновское излучение | Рентгенолюминесценция |
| Электрическая энергия | Электролюминесценция |
Молекула поглощает квант света и переходит из основного состояния S0 в возбужденное электронное состояние S1 (рис. 17.11).
 Рис. 17.11. Cхема энергетических переходов молекулы, иллюстрирующая возникновение флуоресценции (а) и фосфоресценции (б)
Рис. 17.11. Cхема энергетических переходов молекулы, иллюстрирующая возникновение флуоресценции (а) и фосфоресценции (б)
При комнатной температуре молекулы находятся в основном колебательном состоянии. Переходя в возбужденное состояние, молекула попадает на один из его колебательных уровней. Затем за 10-12с происходит переход электрона на нижний колебательный подуровень возбужденного состояния (короткая волнистая стрелка). Этот процесс называют колебательной релаксацией. Возвращение молекулы из нижнего колебательного состояния S1 в невозбужденное состояние S0 может произойти тремя путями:
|
|
|
1) потеря молекулой энергии в виде теплоты в результате столкновений с другими частицами (длинная волнистая стрелка на рисунке а);
2) возвращение молекулы на любой колебательный подуровень основного состояния с испусканием энергии в виде кванта света без изменения спина электрона – флуоресценция (длинная стрелка на рисунке а);
3) переход молекулы из возбужденного состояния S1 в метастабильное состояние Т1, а затем в основное S0 либо в результате внутренней конверсии с выделением теплоты (длинная волнистая стрелка на рисунке), либо с выделением кванта света – фосфоресценция (длинная стрелка на рисунке б). Флуоресценция наблюдается гораздо чаще фосфоресценции, особенно в жидких растворах. Интенсивная фосфоресценция наблюдается у органических соединений в замороженном или в стекловидном состоянии, когда диффузия минимальна.
Рассмотрим основные закономерности молекулярной люминесценции.
1. Независимость спектров люминесценции от длины волны возбуждающего света.
Зависимость интенсивности люминесценции от длины волны или частоты излучения называют спектром люминесценции. Вид спектра не зависит от длины волны возбуждающего света. Это понятно, если вспомнить, что излучение всегда происходит с низшего колебательного уровня первого возбужденного состояния (смотри рисунок выше) независимо от того, какой квант поглощается молекулой и на какой энергетический уровень она при этом перейдет.
|
|
|
В связи с этой закономерностью возникает вопрос, насколько эффективно возбуждающий свет преобразуется в веществе в люминесценцию, ведь часть поглощенной энергии при фотолюминесценции тратится на безизлучательные переходы. В связи с этим энергия испускаемых квантов (hνlum) должна быть меньше энергии поглощаемых квантов:
hνabs > hνlum.
Эффективность преобразования возбуждающей энергии в люминесцентное излучение можно охарактеризовать энергетическим (Вэн) и квантовым (Вкв) выходами люминесценции. Энергетический выход – отношение излучаемой энергии люминесценции к энергии поглощенного света; квантовый выход – отношение числа излученных и поглощенных квантов.
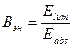

Зависимость энергетического выхода люминесценции от длины волны возбуждающего света подчиняется закону Вавилова: энергетический выход люминесценции с увеличением длины волны возбуждающего света сначала возрастает пропорционально длине волны, затем остается постоянным, а после достижения некоторой граничной длины волны резко падает.
Чем больше квантовый выход люминесценции, тем меньшее количество люминесцирующего вещества может быть обнаружено по его свечению.
2. Закон Стокса – Ломмеля.
Спектр излучения в целом и его максимум всегда сдвинуты по сравнению со спектром поглощения и его максимумом а сторону длинных волн (рис. 17.12). Потеря части энергии поглощаемых квантов света на безизлучательные процессы приводит к тому, что испускаемый квант имеет меньшую энергию и, следовательно, бόльшую длину волны, чем поглощенный.
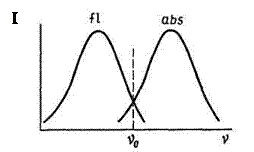 |
Рис. 17.12. Спектры поглощения (abs) и люминесценции (fl), иллюстрирующие закон Стокса-Ломмеля
3. Правило зеркальной симметрии В.Л. Левшина.
Спектры поглощения и люминесценции зеркально симметричны относительно прямой, проходящей через точку пересечения перпендикулярно оси частот.
Спектры необходимо нормировать, так как интенсивность поглощения и излучения получают в разных единицах. Кроме того, эта зависимость соблюдается в координатах Ilum от частоты. Зеркальная симметрия для ряда соединений (родаминовые красители) может выполняться, если спектры изображать в шкале длин волн.
|
|
|
Интенсивность люминесценции при постоянстве квантового выхода люминесценции Вкв и интенсивности возбуждающего излучения:
Ilum = kC,
где С – концентрация флуоресцирующего вещества.
При большой концентрации эта прямолинейная зависимость может не выполняться, наблюдается явление тушения люминесценции. Уменьшение квантового выхода люминесценции называют тушением.
Причины тушения:
– концентрационное тушение вследствие химических изменений в системе. Например, в результате агрегации молекул могут получиться ассоциаты, не обладающие способностью люминесцировать либо имеющие другие измененные спектральные характеристики.
– температурное тушение, которое обусловлено увеличением колебательной энергии молекул и возрастанием вероятности безизлучательного перехода.
– тушение в присутствии примесей. Например, железо, никель и кобальт оказывают сильное тушащее действие на свечение кристаллофосфоров (CaSO4, CaS, SrS, ZnS, CdS и др.) в концентрации 10-5 – 10-6 %. Их называют люминесцентными ядами. Наблюдаемый эффект дает возможность определять железо, никель и кобальт с высокой чувствительностью. Люминесценцию кристаллофосфоров применяют в аналитической практике как высокочувствительный и селективный метод определения лантанидов, урана, некоторых d-переходных элементов.
Приборы для люминесцентного анализа называются флуориметры. Схема флуориметра приведена на рис. 17.13.

Рис. 17.13. Флуорометр:
1 – источник (ртутно-кварцевая лампа); 2 – первичный светофильтр; 3 – кювета с пробой; 4 – вторичный светофильтр; 5 – детектор (фотоумножитель)
Первичный светофильтр пропускает излучение с длинами волн возбуждения, вторичный светофильтр пропускает люминесцентное излучение и задерживает возбуждающее и рассеянное излучение. Особенность – люминесценцию регистрируют под прямым углом.
Применение люминесценции
Метод используют для обнаружения и определения многих неорганических и органических соединений. Ионы некоторых элементов в жидких растворах обладают собственной люминесценцией (лантаноиды Sm, Eu, Gd, Tb, Dy; U(VI).
|
|
|
Для аналитических определений используют комплексные соединения – 8-оксихинолинат алюминия, комплексы алюминия и бериллия с полиоксипроизводными флавонами, магния с оксиазосоединениями.
Большой класс люминесцентных реагентов составляют родаминовые красители, которые с металлгалогенидными комплексами, например, GaCl4–, InBr4–, образуют флуоресцирующие ассоциаты.
Люминесценция – один из самых чувствительных методов анализа – применяется для определения следовых количеств элементов, этот метод позволяет определять от 10 до 10–4 мкг/мл вещества.
Методы, основанные на собственной люминесценции веществ, исключительно селективны в отличие от методов определения элементов, использующих органические реагенты. Избирательность люминесцентного анализа можно повысить, варьируя длину волны возбуждения и регистрации сигнала, время наблюдения в фосфоресцентных методах, рН раствора, температуру и т.д.
Люминесценция широко применяется для определения органических веществ (витамины, лекарства, наркотики). В неорганическом анализе люминесцентный анализ используют в основном для определения редкоземельных элементов, а также малых количеств примесей в полупроводниковых материалах.
 1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн.1.– С. 292-368; Кн.2. – С. 756-769, 778-785.
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х книгах. – М.: Химия, 1990. – Кн.1.– С. 292-368; Кн.2. – С. 756-769, 778-785.
2. Пономарев В.Д. Аналитическая химия. В 2-х частях. – М.: Высшая школа, 1982. – Ч.2. – С. 151-153, 172-183, 211-217.
3. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х книгах. – М.: Высшая школа, 2001. – Кн.2. – С. 303-370.
4. Основы аналитической химии. В 2-х книгах/ Под ред. Ю.А.Золотова. – М.: Высш.шк., 2004. – Кн.2. – С. 273-328, 360-372.
5. Васильев В.П. Аналитическая химия. В 2-х книгах. – М.: Дрофа, 2002. – Кн.2. – С. 50-92, 98-127.
|
|
|


