 |
III . Примеры и задания для самостоятельного решения
|
|
|
|
Пример 1. Назвать следующие соединения: I205, НIO4, H5IO6, КIO3.
Решение.
I205 - оксид иода (V) или пентаоксиддииода;
НIO4 - метаиодиая кислота, тетраоксоиодат водорода;
H5IO6 - ортоиодная кислота или гексаоксоиодат пентаводорода;
КIO3 - традиционное название - иодат калия, систематическое - триоксоиодат калия.
Пример 2. Написать формулы следующих веществ:
а) пероксосульфат диводорода;
б) трисульфиддиаммония;
в) триоксотиосульфат динатрия.
Решение.
а) пероксосульфат диводорода - K2S03(02) или KSO5 - содержит пероксогруппу О 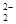 и серу в высшей степени окисления;
и серу в высшей степени окисления;
б) трисульфиддиаммония - (NH4)2S3;
в) триоксотиосульфат динатрия - N2S203 - содержит серу в степени окисления -2 (тио-) и серу в высшей степени окисления, то есть в сульфат-ионе один ион О2- заменен на S  .
.
Пример 3. Классифицировать, полностью охарактеризовать и дать названия следующим комплексным соединениям: а) K3[Ag(SO3S)2];
б) [Co(NH3)4Cl2]Cl;
в) [W(CO)6].
Решение:
а)
1) K3[Ag(SO3S)2] - 3 иона К+ - внешняя сфера, ее общий заряд +3, [Ag(SO3S)2]3- - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3-);
2) Комплексное соединение анионного типа, так как заряд внутренней сферы - отрицательный;
3) Центральный атом - комплексообразователь - ион серебра Ag+
4) Лиганды - два двухзарядных остатка тиосерной кислоты H2S2O3, относится к ацидокомплексам;
5) Координационное число комплексообразователя в данном случае как исключение равно 4 (у двух остатков кислоты 4 валентных σ - связи без 4-х катионов водорода);
|
|
|
6) Заряд комплексообразователя равен +1:
+1 х -2
K3[Ag(SO3S)2]: +1 · 3 + Х + (-2) · 2 = 0 à X= +1
7) Название: – калия дитиосульфатоаргентат (I).
б)
1) [Co(NH3)4Cl2]Cl - 1 ион - Сl- - внешняя сфера, ее общий заряд -1, - [Co(NH3)4Cl2] - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3+);
2) Комплексное соединение катионного типа, так как заряд внутренней сферы – положительный;
3) Центральный атом - комплексообразователь - ион кобальта Со, вычисляем его заряд:
х 0 -1 1+
[Co(NH3)4Cl2]: Х + 0 · 4 + (-1) · 2 = +1 à Х = 0 +2 +1 = +3
4) Комплексное соединение смешанного типа, так как в его составе разные лиганды; ацидокомплекс (Cl-- остаток хлороводородной кислоты) и амминкамплекс - аммиакатный (NH3 - аммиак-нейтральное соединение);
5) Координационное число комплексообразователя равно 6;
6) Название – дихлоротетраамминкобальта(III) хлорид.
в)
1) [W(CO)6] - внешней сферы нет;
2) Комплексное соединение нейтрального типа, так как заряд внутренней сферы = 0;
3) Центральный атом - комплексообразователь - атом вольфрама,
его заряд =0;
4) Карбонилкомплекс, так как лигандом является нейтральная частица - карбонил - СО;
5) Координационное число комплексообразователя равно 6;
6) Название: – гексакарбонилвольфрам
Пример 4. Какие оксиды вступают в реакцию с соляной кислотой -HCl:
а) СuO; б) SiO; в) BeO?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакuии с кислотой образует соль и воду:
CuO + 2НCl = CuCl2 + H2O;
б) оксид кремния (IV) SiО2 - кислотный, следовательно, в реакцию с кислотой не вступает;
в) оксид берилия BeО - амфотерный, следовательно, в реакuии с кислотой образует соль и воду:
BeO + 2НCl = BeCl2 + H2O.
|
|
|
Пример 5. Какие оксиды вступают в реакцию с гидроксидом натрия -NaOH:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид меди (II) CuО - основной, следовательно, в реакцию со щелочью не вступает;
б) оксид серы (IV) SО2 - кислотный, следовательно, в реакцию со щелочью вступает и образует соль и воду:
SО2 + 2NaOH = Na2SO3 + H2O;
в) оксид алюминия Al2O3 - амфотерный, следовательно, в реакuии со щелочью образует соль и воду:
Al2O3 + 2NaOH = 2Na AlO2 + H2O.
Пример 6. Составьте формулы гидроксидов, соответствующих оксидам:
а) FeO; б) SO2; в) Al2O3?
Решение:
а) оксид железа (II) FeО - основной, следовательно, соответствующий гидроксид - основание, в формуле число гидроксогрупп (ОН) равно валентности металла (II) или степени окисления (+2); формула гидроксида - основания Fe(OH)2;
б) оксид серы (IV) SО2 - кислотный, следовательно, соответствующий гидроксид - кислота:
SО2 + H2O = Н2SO3;
в) оксид алюминия - амфотерный, следовательно, соответствующий гидроксид - амфотерен. Амфотерные гидроксиды, чаще, записывают в форме оснований - Аl(OH)3.
Пример 7. Составьте формулы а) гидроксида хрома(+3);
б) фосфорной кислоты
Решение:
а) гидроксид хрома (+3) - амфотереный, формула Cr(ОН)3; кислотная ортоформа - H3CrO3 и метаформа (с меньшим содержанием воды) - HCrO2;
б) Данное название кислоты (- ная) соответствует максимальной валентности (степени окисления) фосфора (+5). Формулу кислоты можно вывести:
1) P 2О5 + H2O = 2НPO3 - метафосфорная кислота
P 2О5 + 3H2O = 2Н 3 PO4 - ортофосфорная кислота;
2) общая условная формула гидроксида фосфора Р(ОН)5; при последующем постепенном вычитании двух молекул воды получаются ортофосфорная и метафосфорная кислота, соответственно.
Пример 8. Составьте формулы: а) карбоната хрома (+3);
б) гидросульфата бария;
в) сульфита дигидроксоалюминия
|
|
|
Решение
а) Сr 3+ и CO32- - ион хрома и двухзарядный (двухвалентный) остаток угольной кислоты - карбонат-анион. Составляем формулу, учитывая валентности:Сr2(CO3)3;
б) Ba2+ и анион, в котором с сульфат-ионом связан один катион водорода HSO4-. Составляем формулу: Ba(HSO4)2
в) катион, в котором ион алюминия Al3+ связан с двумя гидроксогруппами OH- т.е., Al(OH)2+ и анион SO32-. Составляем формулу, учитывая валентности (заряды) этих двух ионов: (Al(OH)2)2 SO3.
Задание 9. Составьте формулы:
а) гидроксида марганца (+2);
б) хлорной кислоты (с высшей степенью окисления хлора);
в) гидроксида свинца (+4) и его кислотных орто- и метаформ.
Задание 10. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция и ортофосфорной кислотой. Дайте им название.
Задание 11. Составьте формулы:
а) карбоната хрома (+3);
б) гидросульфата бария;
в) дигидроксосульфита алюминия
(или сульфита дигидроксоалюминия).
Задание 12. Составьте формулы солей:
а) дигидрофосфата меди (+2);
б) нитрата кобальта (+3);
в) гидроксохлорида железа (+3).
Задание 13. Составьте формулы всех солей, которые могут быть образованы гидроксидом кальция - Ca(OH)2 и сернистой кислотой - H2SO3
Приведите названия полученным соединениям.
Задание 14. В реакциях, между какими веществами возможно образование кислых солей: a) Na2S + H2S;
б) KOH + H3PO4;
в) Al(OH)3+ HBr;
г) NaOH + SO2 (изб.).
Напишите уравнения реакций, дайте названия продуктам реакции.
Задание 1 5. Охарактеризуйте комплексные соединения:
а) Li3 Cr (OH)6]
б) [Zn(H2O)3 F] I2
|
|
|
в) [ Pt Cl2 (NH3)2]
и дайте им названия.
Задание 16. Назовите комплексные соединения и дайте им названия
[Co(NH3)4(NO2)2]NO3,
K3[Al (C2O4)3 ],
Na3[Co(NO2)6],
H[AuCl4],
Fe3[ Cr (CN)6]2
Библиографический список
1. Бокий Г.Б., Голубкова Н.А. Введение в номенклатуру ИЮПАК. Москва, «Наука», 1989.
2. Гликина Ф.Б., Ключников Н.Г. Химия комплексных соединений. Москва, «Просвещение», 1982
3. Бусев А. И., Ефимов И. П., Словарь химических терминов. Пособие для учащихся, М., 1971г.
4. Гринвуд Н., Эрншо А. Химия элементов. - Т.1. - М.: БИНОМ. Лаборатория знаний, 2008 г. - С. 150-155, 272-273.
5. Емельянов В.А. Общая химия. Классификация и номенклатура неорганических соединений: Методическое пособие для студентов геолого-геофизического факультета. - Новосибирск: НГУ, 2002 г. - 24 с.
6. Кан Р., Дермер О. Введение в химическую номенклатуру. - М.: Химия, 1983 г. - С. 20-60, 192-200.
7. Лабораторный практикум по общей химии, под ред. С. Л. Погодина, 2 изд., М., 1972 г., с. 27—33.
8. Лидин Р.А., Аликберова Л.Ю., Логинова Г.П. Неорганическая химия в вопросах. - М.: Химия, 1991 г. - С. 185-195.
9.Лурье Ю.Ю. Справочник по аналитической химии. Москва, «Химия», 1989.
10. Лучинский Г. П., Номенклатура неорганических соединений, в кн.: Краткая химическая энциклопедия, т. 3, М., 1964 г.
11. Материалы к проекту номенклатуры неорганических соединений, М., 1968 г.
12. Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973 г. - С. 54-57.
13. Новый справочник химика и технолога. Основные свойства неорганических, органических и элементоорганических соединений. - С-Пб.: АНО НПО Мир и семья. – 2002 г. - С. 5-23.
14. Nomenclature of Inorganic Chemistry. IUPAC recommendatins 2005. - International Union of Pure and Applied Ch.
Приложения.
Таблица 1.
|
|
|


