 |
Физико-химические свойства белков
|
|
|
|
Выделение и очистка белков. Первым этапом выделения и очистки белков является извлечение их из клеток. Для этого клетки разрушают, т. е. превращают в шмогенат (разрушают клеточные оболочки, наружные мембраны, цитоплазматические структуры). Существуют различные методы гомогенизации клеток и тканей, и выбор того или иного метода определяется свойствами, составом, прочностью исходного объекта. Большинство животных клеток разрушается легко, однако при работе с растительными и бактериальными клетками встречаются трудности, обусловленные наличием клеточных оболочек.
Для разрушения клеток также используют специальные приборы — ультразвуковые дезинтеграторы. Существуют методы разрушения клеток с помощью осмотического шока, попеременного замораживания и оттаивания, обработки органическими растворителями (охлажденный ацетон, толуол), автолиза. Для удаления оболочек растительных и бактериальных клеток могут быть применены ферментативные препараты — лизоцим, комплекс целлюлолитических ферментов, хитиназа.
На всех этапах выделения и очистки белков следует учитывать их большую неустойчивость, лабильность, склонность к потере природных, нативных свойств, т. е. к денатурации. Белки чувствительны к действию многих химических реагентов (кислот, щелочей, органических растворителей), денатурируют при нагревании.
В большинстве случаев процесс разрушения клеток сопровождается выделением тепла, поэтому все процедуры по дезинтеграции клеток и выделению клеточных органелл с целью предотвращения тепловой денатурации следует проводить при пониженных температурах (около +4°С) в термостатированных холодных комнатах. Чтобы устранить воздействие ионов тяжелых металлов, которые могут попасть с водой и реактивами при гомогенизации, используют комплексообразователи — ЭДТА (этилендиаминтетраацетат), егонатриевую соль — трилон Б и др.
|
|
|
HOOC - H2C CH2 – COOH
\ /
N – CH2 - CH2 – N
/ \
HOOC – H2C CH2 – COOH
ЭДТА (версен)
Для предотвращения окисления сульфгидрильных групп в белках в среду выделения добавляют восстановители, например цистеин, β-меркаптоэтанол, дитиотреитол и некоторые другие.
HS – CH2 – CH2 – OH
Меркаптоэтанол
CH2 – CH – CH – CH2
I I I I
SH OH OH SH
Известно, что многие белки локализованы в клеточных органеллах. Для их выделения гомогенат, полученный после разрушения клеток, подвергают центрифугированию. В зависимости от величины центробежного ускорения в осадке получают те или иные органеллы, с которыми затем проводят работу по выделению белка. Методом центрифугирования можно также отделить твердые частицы-обломки клеточных структур. Надосадочная жидкость (экстракт) представляет собой водный раствор различных органических и неорганических соединений — компонентов клетки и среды солюбилизации (растворения).
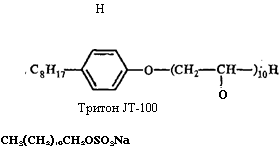
Додецилсульфат натрия
Неионные детергенты, такие, как дезоксихолат натрия, тритон Х-100, широко применяющиеся для солюбилизации мембранных белков, ослабляют гидрофобные белково-липидные и белок-белковые взаимодействия, в результате чего белки высвобождаются из мембран. Анионные и катионные детергенты дестабилизируют также и ионные связи между заряженными группами компонентов мембран. Примером анионного детергента, использующегося для выделения белков мембран, является додецилсульфат натрия (ДСН, SDS).
После гомогенизации материала производится экстрагирование из него белков. В качестве растворителей в зависимости от свойств выделяемого белка и целей исследований применяют воду, солевые растворы, разнообразные буферные смеси, органические реагенты, водно-спиртовые растворы, слабые кислоты или щелочи. Очень часто экстракцию белков осуществляют в процессе гомогенизации материала.
|
|
|
Выделенные препараты белка должны быть проверены на гомогенность. Прямых методов оценки чистоты белков не существует, гомогенность образца оценивают по отсутствию примесей. Вещество считают чистым, если ни один из методов определения гомогенности не выявит наличие примесей. С этой целью применяют обязательно несколько методов, основанных на разных принципах. Гомогенность образца по молекулярной массе устанавливают ультрацентрифугированием, по величине заряда — электрофорезом в ПААГ, ИЭФ. Чистое вещество дает только один симметричный пик при ультрацентрифугировании. Инъекция гомогенного вещества вызывает образование антител одного вида, а гетерогенного — нескольких видов.
Выделенный и очищенный белок должен храниться при пониженной температуре. Если белок кристаллизуется из раствора сульфата аммония, его можно хранить в этом растворе в виде суспензии. Чаще всего белки хранят в высушенном состоянии; сушку производят под высоким вакуумом из замороженного состояния (лиофилизация).
Молекулярная масса белков и методы ее определения. Молекулярная масса белков может быть определена физическими методами, наиболее часто используют гравитационный, гельфильтрационный и электрофоретический. Современные методы позволяют определять молекулярные массы с погрешностью, не превышающей 5%, что составляет несколько тысяч, а иногда и сотен дальтон. Выяснение первичной структуры многих индивидуальных белков дало возможность рассчитать их молекулярную массу с высокой точностью.
Молекулярные массы различных белков колеблются в широких пределах: от 6 тыс. до нескольких миллионов дальтон. Ниже приведены молекулярные массы некоторых белков.
Белок Молекулярная масса
Инсулин…………………………………5 700
Рибонуклеаза……………………………14 000
Пепсин…………………………………..35 500
Сывороточный альбумин………………66 500
Каталаза…………………………………250 000
Уреаза……………………………………480 000
Гемоцианин……………………………..2 800 000
Амфотерные свойства белков. Белки являются амфотерными электролитами, так как в их молекуле присутствуют как кислотные, так и основные группировки. Кислотно-основные свойства белков определяются главным образом боковыми радикалами аминокислот, способными к ионизации. Вклад концевых NH2- и СООН-групп крайне незначителен. Величины рК боковых радикалов аминокислот в составе белков несколько отличаются от таковых в свободных аминокислотах, поскольку степень ионизации групп в белках зависит от природы соседних боковых радикалов т. е. от электростатического окружения.
|
|
|
Присутствие диссоциирующих группировок в белках обусловливает определенный суммарный заряд молекулы, зависящий от рН среды. Большинство природных белков относится к кислым белкам благодаря значительному содержанию дикарбоновых кислот и поэтому при рН, близких к нейтральным, имеет, как и цитоплазма, в целом, отрицательный заряд.
Аминокислоты с диссоциирующими боковыми радикалами вхдят в состав всех белков, где они преимущественно располагаются на поверхности глобулы и тем самым определяют гидрофильность молекулы в целом, а также ряд других физико-химических свойста белковых молекул. Распределение заряда на поверхности молекулы неравномерно, различные участки ее могут иметь противоположные заряды, стабилизированные диполями воды. Сдвиг рН среды приводит к изменению характера диссоциации радикалов перераспределению зарядов на поверхности молекулы, следствием чего является изменение пространственной структуры белков и степени их биологической активности.
Для каждого белка существует такое значение активной реакции среды, при котором положительные и отрицательные заряды в молекуле скомпенсированы. Значение рН, при котором белок не несет суммарного заряда и не движется в электрическом поле, называют изоэлектрической точкой (ИЭТ) и обозначают как pI. Величина ИЭТ может быть определена по кривым, полученным при кислотно-основном титровании белкового раствора, а также при изоэлектрофокусировании белка. Ниже приведены изоэлектрические точки некоторых белков.
|
|
|
Белок pl
Пепсин…………………………………………. 1,0
Уреаза…………………………………………... 5,1
Каталаза………………………………………… 5,6
Рибонуклеаза…………………………………… 7,8
Лизоцим………………………………………… 11,0
Значение рН, отвечающее ИЭТ белка, определяется числом его ионогенных групп и величинами их констант диссоциации (рК). ИЭТ выше 7, если белок содержит большое число остатков основных аминокислот, и менее 7 при преимущественном содержании кислых аминокислот. Для большинства глобулярных белков ИЭТ лежат в кислой области (4,5—6,5). Есть и исключения. Например, фермент пепсин, функционирующий в сильно кислой среде желудка, имеет ИЭТ около 1, а протамины — около 12.
Растворимость белков. Большинство белков – гидрофильные вещества, хорошо растворимы в водных растворах. Растворимость их, как и других высокомолекулярных веществ, определяется природой тех групп, которые оказываются на поверхности молекулы при ее пространственной укладке в нативную конформацию. Большая часть белковой молекулы образована группами, способными гидратироваться. Под гидратацией понимают связывание диполей воды с ионами и полярными группами.
В растворах белки обладают коллоидными свойствами: они медленно диффундируют, не проходят через полупроницаемую мембрану, рассеивают свет, характеризуются высокой вязкостью. Однако следует иметь в виду, что белковые растворы не являются типичными коллоидными растворами, так как белки диспергированы до единичных молекул и образуют гомогенный раствор. В отличие от них типичные коллоидные растворы гетерогенны, двухфазны (растворенное вещество и растворитель), коллоидные частицы (мицеллы) растворенного вещества состоят из нескольких молекул. Сходство белковых и истинных коллоидных растворов в том, что молекулы белков имеют размеры, приближающиеся к размеру мицелл коллоидного раствора.
Образование коллоидных растворов белками и другими биологическими макромолекулами обусловливает многие физико-химические явления, наблюдающиеся в биологических жидкостях и организмах в целом. Растворы белков, как и все коллоидные растворы, могут при определенных условиях терять свою текучесть и образовывать гели, или студни. Гели возникают в результате объединения молекул в виде сетки, внутреннее пространство которой заполнено большим количеством растворителя, при этом разделения на жидкую и твердую фазы, как в случае коагуляции, не происходит. Полагают, что в ряде растительных и животных тканей белки находятся не только в виде растворов, но и гелей (в протоплазме клеток хрусталике глаза, соединительной ткани и др.). В состояние геля белковые растворы, например молоко, могут переходить под воздействием ферментов микроорганизмов, результатом чего является образование простокваши, кефира. При подготовке растений к зимнему периоду жизни, в процессе так называемого осеннего «закаливания» происходит переход части белков из растворенного состояния в гелеобразное.
|
|
|
Гели по истечени времени стареют, отслаивают воду и делятся на две фазы: уплотненный гель и разведенный золь. Этот процесс получил название синерезиса, он протекает, например, при стоянии кефира. Одним из свойств гелей является их способность к набуханию — увеличению объема за счет связывания большого количества воды. Такой процесс происходит, например, при прорастании семян. Белки соединительных тканей животных, поглощая воду, осуществляют тем самым ее запасание организмом. Набухание играет большую роль в технологии кожевенной промышленности, хлебопечении.
В растворах белков и других высокомолекулярных соединений может наблюдаться явление коацервации — слияния водных оболочек нескольких частиц без объединения самих частиц. Коацерваты возникают при ограниченной растворимости компонентов раствора, это служит причиной появления коацерватных капель. Коацерваты образуются, например, из белков с противоположными зарядами. Им придают большое значение в теории происхождения жизни, однако в отличие от биологических неравновесных структур коацерваты термодинамически равновесны.
Благодаря гидрофильным и гидрофобным группировкам белки могут влиять на растворимость других веществ, выступая в роли эмульгаторов — веществ, стабилизирующих эмульсию, которую образуют взаимно нерастворимые жидкости (вода — масло). В организме человека в эмульгированном состоянии находятся жиры в крови и лимфе. Белок образует на поверхности капелек жира тонкую пленку, которая притягивает воду и препятствует слипанию жировых частичек. Одной из причин образования мочевых и желчных камней может быть недостаток в организме муцинов — слизистых гликопротеинов, обволакивающих гидрофобные микрочастицы и способствующих тем самым их выведению из организма.
Денатурация белков. Под денатурацией белка понимают нарушение нативной пространственной структуры белковой молекулы, приводящее к уменьшению или полной потере ее растворимости, изменению других физико-химических свойств белка, утрате специфической биологической активности. Денатурация сопровождается разрывом ковалентных связей в остове полипептидной цепи. Дисульфидне мостики расщепляют, гидрофобные, ионные, водородные связи. В результате нарушается нативная третичная структура и в значительной мере вторичная. Денатурацию белковых молекул вызывают как некоторые химические соединения, так и физические факторы. Механизм денатурирующего воздействия химических агентов определяется их строением. Например, мочевина, гуанидинхлорид, формамид благодаря наличию амидной группировки конкурируют с пептидными группировками белка за водородные связи, переключая их на себя. Эти реагенты нарушают также гидрофобные взаимодействия. Максимальное денатурирующее влияние мочевина и другие амиды проявляют в больших концентрациях (6М-10М).
Денатурирующее действие умеренно полярных органических растворителей (низшие спирты, этиленгликоль, диоксан, диметилсульфоксид и др.) связано с резким уменьшением диэлектрической константы водных растворов белков, вследствие чего увеличиваются электростатические силы взаимодействия между заряженными-группами. Образование прочных внутри- и межмолекулярных ионных связей и приводит к денатурации белков. Ионные детергенты, например додецилсульфат натрия, соединяются с противоположно заряженными группами белка. Электростатическое отталкивание оставшихся в пептидной цепи одноименно заряженных групп приводит к разрыву водородных связей и других слабых взаимодействий, стабилизирующих нативную конформацию белка.
Денатурирующими агентами являются также катионы тяжелых металлов и анионы иода, тиоцианата. Эти вещества, повидимому, образуют достаточно прочные соединения с полярными группами белков, искажая систему ионных и водородных связей.
Многие белки денатурируют при сильном подкислении (рН<2—3) или подщелачивании (рН>10—11).
Из физических факторов денатурации наиболее общим является нагревание. Усиление теплового движения полипептидных цепей приводит к разрыву водородных связей и нарушению гидрофобных взаимодействий. Скорость тепловой денатурации существенно зависит от активной реакции среды, присутствия солей, их концентрации. Тепловая денатурация сопровождается агрегацией белков, выпадением их в осадок, что представляет собой уже вторичное явление.
Существуют многочисленные данные о том, что у термофильных микроорганизмов большинство белков обладает повышенной термостабильностью. При нагревании до 60°С они не денатурируют, претерпевают лишь небольшие конформационные изменения, в то время как у белков мезофиллов (организмы, обитающие при обычных, средних температурах) при +60°С наблюдается существенная денатурация. У мезофиллов лишь редкие белки обладают повышенной термостабильностыо.
Белки денатурируют и при многих механических воздействиях: высоком давлении (5000—10 000 атм), растирании сухих препаратов, энергичном встряхивании растворов, облучении звуковыми волнами высокой частоты. Все это следует учитывать при биохимических исследованиях белков. При лиофилизации большинство белков не денатурирует, это позволяет использовать этот способ сушки для получения белковых препаратов длительного хранения.
Физическими факторами денатурации белков являются ультрафиолетовый свет (особенно в границах 260—310 нм), ионизирующее излучение. Денатурация белка происходит при распределении его на границе раздела двух фаз, такая поверхностная денатурация наблюдается при вспенивании белковых растворов в процессе выделения белков и при образовании пены на поверхности водоемов.
При денатурации белков изменяются многие физико-химические свойства белка: растворимость, константа седиментации, вязкость, оптические свойства и др. В процессе денатурации белков с четвертичной структурой может происходить их диссоциация на субъединицы. В белке существенно уменьшается количество участков с регулярными типами вторичной структуры, снижается количество внутримолекулярных водородных связей и возрастает число этих связей между белком и водой. Поскольку при денатурации происходит нарушение гидрофобных взаимодействий в процессе развертывания белковой молекулы и гидрофобные группы оказываются на поверхности молекулы, это вызывает потерю растворимости и набухаемости белков в водных растворах.
При денатурации белка выявляются реактивные группы, которые в нативном белке не полностью доступны для обнаружения обычными методами (сульфгидрильные, фенольные, имидазольные и др.). Изменение числа реактивных групп при денатурации проявляется и в изменении ИЭТ белков. Как правило, изоэлектрическая точка смещается в сторону щелочных значений рН. Денатурация белков сопровождается возрастанием отрицательной оптической активности
Превращение компактной молекулы в беспорядочный клубок, происходящее при денатурации, приводит к тому, что большинство пептидных связей становится доступным действию протеолитических ферментов. В связи с этим протеолиз денатурированных белков протекает с большей скоростью, чем нативных.
Медленная денатурация белков происходит при длительном хранении семян, в результате чего у них уменьшается набухаемость и, как следствие, снижается интенсивность прорастания.
Полная денатурация белка в большинстве случаев необратима, однако при подборе соответствующих условий иногда удается ренатурировать белки. Способность к ренатурации после нагревания показана, например, для фермента трипсина. Необходимым условием его ренатурации является очень медленное охлаждение белка до комнатной температуры («отжиг»), при этом восстанавливается нативная конформация и специфическая биологическая функция трипсина.
Оптические свойства. Все белки, поглощают ультрафиолетовый (УФ) свет в трех областях. Поглощение при длинах волн (λ) более 250 нм с максимумом около 280 нм обусловлено присутствием исключительно ароматических аминокислот — триптофана, тирозина и фенилаланина. Интенсивность поглощения в этой области меняется в основном в зависимости от количества α-спиральных структур в белке.
Спектрофотометрия позволяет также устанавливать зависимость оптической плотности растворов от длины волны поглощаемого света, т. е. получать спектры поглощения, и, кроме того, используется для определения пространственного расположения ароматических аминокислот в белковой глобуле (внутри или снаружи). Метод дифференциальной спектрофотометрии позволяет установить и степень полярности окружения ароматической аминокислоты, находящейся внутри глобулы. В видимом диапазоне спектра (380—760 нм) способностью поглощать свет обладают только окрашенные белки, так называемые хромопротеины — гемоглобины, цитохромы, флавопротеины, «голубой белок» из Pseudomonas, интенсивно поглощающий свет с длиной волны около 600 нм, и некоторые другие.
В инфракрасной (ИК) области спектра (760—10 000 нм) поглощают свет все белки. ИК-спектроскопию широко используют для определения относительного содержания α-спиралей, β-структур и аморфных участков в белковой молекуле.
Белковые растворы обладают способностью флуоресцировать — испускать квант света при переходе из электронно-возбужденного состояния в основное. На этом свойстве белков основана флуоресцентная спектроскопия — измерение интенсивности испускаемого света при возбуждении образца (поглощение им кванта света при облучении УФ- светом). Спектр флуоресценции всегда бывает смещен относительно спектра поглощения в длинноволновую область, так как при переходе из возбужденного состояния в основное молекула теряет энергию.
Флуоресцирующими аминокислотными остатками в белках являются триптофан, тирозин и фенилаланин. Флуоресценцию каждого из них можно отличить по длине волны, при которой она наблюдается. Измерение флуоресценции дает сведения о конформационных перестройках белков, местах связывания лигандов, взаимодействиях с растворителем, степени гибкости молекулы, межмолекулярных расстояниях и др.
|
|
|


