 |
Строение белковой молекулы
|
|
|
|
Полипептидное строение белков. Первые белковые вещества выделили более 250 лет назад, а во второй половине 18 — начале 19 вв. уже неоднократно описывали белковые вещества растений и животных.
В настоящее время хорошо известен химический элементарный состав белков. Они обычно содержат 50—55% С, 21—23% 02, 15—17% N2, около 7% Н2, от 0 до 3% S. В сложные белки, кроме того, могут входить Р и некоторые металлы.
По современным данным, наиболее часто в составе различных белков обнаруживают 20 видов аминокислот. Именно для 20 аминокислот существует генетический код в виде триплетов (тройки нуклеотидов в ДНК). Иногда в белках присутствуют и другие аминокислоты, они образуются в результате модификации белков уже после их биосинтеза, являются некодируемыми (цистин, гидроксипролин, гидроксилизин и некоторые другие). В составе белков обнаружены только α-аминокислоты, в подавляющем большинстве в L-конфигурации.
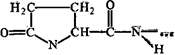
Аминокислоты соединяются друг с другом ковалентной пептидной или амидной связью. Образование ее происходит за счет аминогруппы (NH2) одной аминокислоты и карбоксильной группы (—СООН) другой с выделением молекулы воды.
О R2 O R2
II I II I
H2N—СН—С—ОН + Н—N—СН—СООН →H2N—СН—С—N—CH—СООН + Н20
I I I I
R1 H R1 H
Транспептиднаясвязь
В природе распространена транспептидная связь, реже встречается менее устойчивая цис-пептидная связь. Пептидная связь является частично двойной, частично одинарной, между этими структурами есть взаимный переход. Время жизни одинарной связи несколько больше, чем двойной (6:4), пептидная связь на 60% одинарна и на 40% двойная.
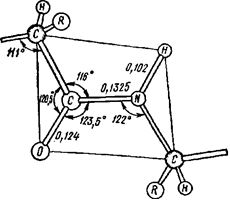
В результате явления резонанса образуется флуктуирующая, динамическая связь, которую невозможно описать на основе одной валентной структуры. Так как вращение вокруг двойной связи заторможено, все атомы пептидной связи оказываются расположенными примерно в одной плоскости, т. е. она планарна, только вокруг атома азота связи отчасти сохраняют пирамидальный характер. В настоящее время установлены все валентные углы и длины связей в пептидных группировках (рис. 3).
|
|
|
Рис. 3. Межатомные растояния (нм) и углы в пептидной связи. Все атомы внутри рамки находятся примерно в одной плоскости.
Образованные аминокислотами полимеры называют пептидами или белками в зависимости от числа входящих в них структурных единиц. Условно принято, что пептиды, содержащие до 20 аминокислотных остатков, относятся к олигопептидам, среди них различают ди-, три-, тетрапептиды и т. д. Полипептиды имеют в молекуле от 20 до 50 аминокислотных остатков. Пептидные цепи, объединяющие более 50 аминокислот и имеющие молекулярную массу свыше 6 тыс., относятся к белкам.
Самый низкомолекулярный белок — гормон инсулин, состоящий из 51 аминокислотного остатка. Число аминокислотных звеньев в белке может доходить до нескольких сотен и даже тысяч. Количество видов белков в природе огромно, их разнообразие связано с различным набором аминокислот, входящих в белок, и порядком их чередования в молекуле. Так, уже из трех аминокислот можно получить 6 различных трипептидов, из четырех – 24 тетрапептида, пяти — 120 пентапептидов, из 11—40 млн. изомеров, а из 20 разных аминокислот, каждая из которых встречается только один раз, теоретически может образовываться астрономическое число (2·1018) изомеров. Однако в живой природе реализуется только малая доля возможных изомеров.
Для описания строения белковых молекул были введены понятия о первичной, вторичной, третичной и четвертичной структурах.
Первичная структура. Под первичной структурой белковой молекулы понимают порядок чередования аминокислот в полипепдептидной цепи (или цепях) и местоположение дисульфидных связей. Полипептидная цепь содержит на одном конце свободную аминогруппу (N-конец), на другом — карбоксильную группу (С-конец). За начало цепи принимается ее N-конец, именно отсюда начинается отсчет аминокислот. Это совпадает с направлением синтеза полипептидной цепи на рибосоме, которое в свою очередь отвечает направлению 5'—3´ мРНК.
|
|
|
Аминогруппа на N-конце полипептидной цепи может быть иногда ацетилированной, присоединившей остаток уксусной кислоты (СНз—СО—NH). Блокированные за счет ацетилирования N-концы характерны также для белков оболочки многих растительных вирусов, некоторых вирусов животных и бактерий.
На С-конце встречается либо свободная карбоксильная группа (у большинства белков), либо амидированная (некоторые гормоны, пчелиный яд). Модификации С-конца более редки по сравнению с N-концевыми модификациями.
Названия отдельных пептидов образуются в соответствии с составляющими их аминокислотными остатками, начиная с N-конца. При этом в названиях всех аминокислот, за исключением последней, меняется окончание на «ил». Например, L-аланил-L-цистеил-L-метионин. Полная аминокислотная последовательность белков указывается в виде сокращенных названий аминокислот. Принято трехбуквенное и однобуквенное обозначение аминокислот (табл. 5).

Таблица 5. Обозначения аминокислотных остатков
Основная связь первичной структуры белков – пептидная связь. Эта связь достаточно жесткая и поэтому конформационная подвижность ее ограничена.
Различия в структуре гомологичных белков также дают ценную информацию о роли отдельных аминокислотных остатков в функционировании молекулы. Остатки, находящиеся в активных участках или определяющие конформацию полипептидной цепи, не могут быть изменены генетически или путем химической модификации без влияния на функцию. Так, известные в настоящее время вариации первичной структуры в цитохроме с разных видов живых организмов не связаны со значительными изменениями функциональных свойств белка, поскольку наименее изменяемыми являются участки вблизи связывания гема, а также участки, ответственные за пространственную укладку
|
|
|
цепи.
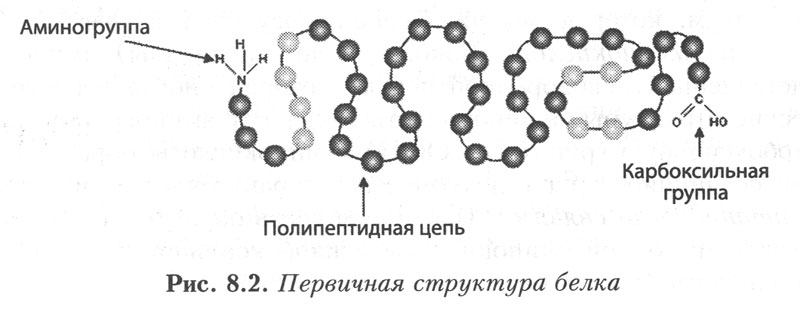
Рис. 4. Первичная структура белка
Установление чередования аминокислот в белках показало также, что в процессе эволюции происходило удвоение и слияние генов. С дупликации соответствующих генов обычно начинается дифференциация белков.
Вторичная структура. Вторичная структура — это упорядоченное пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот. Она образуется за счет замыкания водородных связей между пептидными группами. Вторичная структура представлена в основном такими регулярными структурами как α-спираль, складчатые слои (β-структура), β-изгиб. Часть полипептидной цепи не имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями.
В α-спиральных участках и участках с β-складчатой структурой все последовательно расположенные пептидные звенья полипептидной цепи имеют идентичные взаимные ориентации, поскольку все торсионные углы φ и все углы ψ у Сα одинаковы. В таком случае участок полипептидной цепи имеет линейную структуру, которая формируется из линейных групп.
Линейная группа представляет собой виток спирали, параметры которой (смещение вдоль оси, приходящееся на повторяющийся элемент, число элементов на виток, радиус и др.) зависят от величины углов ф и ψ. Спираль с числом элементов в витке менее двух невозможна. В белках обнаружено несколько типов линейных групп, не имеющих стерических затруднений; они стабилизированы водородными связями либо в пределах одного участка полипептидной цепи (спираль), либо между соседними участками (β-складчатая структура).

Рис. 5. Антипараллельная β-структура белка.
Складчатые слои могут образовываться не только одной полипептидной цепью (при этом водородные связи будут внутри данной цепи), но и группой близко расположенных полипептидных цепей в молекуле (водородные связи будут замыкаться между цепями). β-Структура второго типа характерна для таких фибриллярных белков, как фиброин шелка, кератин волос, состоящих из нескольких полипептидных цепей. У глобулярных белков в формировании β-складчатой структуры принимает участие обычно около 15% аминокислотных остатков полипептидной цепи. Большинство складчатых слоев содержит менее шести цепей. Как правило, складчатые слои не являются плоскими, для них характерна небольшая левая закрученность.
|
|
|
 Третичная структура. Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Третичная структура. Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару. В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
Фибриллярные белки выполняют в организме, в основном, структурную функцию. Это плохо растворимые или нерастворимые белки, отличающиеся высоким содержанием неполярных аминокислот. К ним принадлежат, например, белки соединительных и сократительных тканей, волос, кожи, некоторые белки клеточных оболочек растений, водорослей и ряд других белков.
 Четвертичная структура. Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000—100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Четвертичная структура. Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000—100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Под четвертичной структурой понимают способ взаимного расположения в пространстве отдельных полипептидных цепей в молекуле, характер связей между ними. К белкам с четвертичной структурой относят иногда и сложные надмолекулярные белковые структуры, в которых объединяются до нескольких сотен субъединиц, например, жгутики бактерий, головки вирусов и т. д.
|
|
|


