|
Обмен липидов.. Желчные кислоты.
|
|
|
|
Обмен липидов.
Липиды - это гетерогенная группа соединений, общим свойством которых является нерастворимость в воде, а растворимость в полярных растворителях: эфир, хлороформ, бензол.
Все они непосредственно или апосредовано связаны с жирными кислотами. Вопросы:
1. структура и функция липидов в организме человека,
2. переваривание и всасывание жиров. Синтез желчных кислот
3. образование транспортных форм липидов (жиров)
4. обмен жирных кислот: |3-окисление, синтез жирных кислот; строение
пальмитатсинтазного комплекса. Регуляция.
5. метаболизм кетоновых тел
6. обмен жиров: депонирование и мобилизация.
7. обмен холестерина. Синтез, образования транспортных форм. Атеросклероз
Функции липидов в организме.
Они служат депонированным источником энергии, обеспечивают теплоизоляцию, являются структурными компонентами биологических мембран, выполняют регуляторную функцию (гормоны). Липиды классифицируются на:
1. простые - это сложные эфиры жирных кислот с различными спиртами: жиры - это
эфиры жирных кислот и глицерина; воска - сложные эфиры жирных кислот с
многоатомными спиртами
2. сложные - это сложные эфиры жирных кислот со спиртами, дополнительно
содержащие другие группы.
- фосфолипиды (глицерофосфолипиды, сфинголипиды)
- гликолипиды
- другие сложные липиды: аминолипиды, липопротеины.
3. производные и предшественники липидов: глицерол, жирные кислоты, стероиды
(желчные кислоты, стероидные гормоны), кетоновые тела, жирорастворимые витамины
А, Д, Е, К и витамин или фактор F (включает в себя полиненасыщенные незаменимые
или эссенциальные жирные кислоты - линолевая, линоленовая и арахидоновая кислота).
Подробнее на стр. 188-203
|
|
|
Жиры или триацилглицериды (нейтральные жиры, триглицериды) - это сложные эфиры
глицерина и жирных кислот, являются главным компонентом жиров, запасаемых в
клетке.
Жиры могут находится в организме в двух видах:
1. в виде капелек жиры в цитоплазме - цитоплазматический жир. Его количество и
состав не меняется с возрастом и состоянием организма,
2. запасный жир в жировых депо. Его количество меняется в зависимости от пола,
возраста и состояния организма.
Триацилглицериды образуются, если 3 ОН-группы этерефицированы жирными
кислотами, они составляют основную массу всех жиров. Если этерифицированы 2
группы - это диацилглицеролы, если 1 - это моноацилглицеролы.
ТАГ (триацилглицеролы) могут быть простыми, если во всех трех положениях остатки
одной и той же жирной кислоты; сложными, если в трех положениях стоят различные
жирные кислоты (например, R1 - пальмитиновая, R2- стеариновая, R3 - лауриновая).
1 -пальмитоил - 2 - стеароил - 3 - лауроилглицерин.
При кипячении с кислотами и основаниями ТАГ подвергаются гидролизу (отщепление
жирных кислот в виде натриевых или калиевых солей, которые называются мылами).
Аналогичные продукты получаются при действии фосфолипаз поджелудочной железы.
Жиры растительного происхождения имеют в своем составе ненасыщенные жирные
кислоты ( поэтому температура плавления у них низкая ), животные жиры содержат более насыщенные жирные кислоты (температура плавления выше). При комнатной температуре животный жир твердый, растительный - жидкий.
Переваривание и всасывание жиров.
Катаболизм жиров включает в себя расщепление до СО2 и H2O в 3 стадии
Переваривание жиров включает в себя несколько стадий: эмульгирование, гидролиз
липазой, образование мицелл, всасывание, ресинтез, образование транспортных форм
жиров.
В организме существует 3 вида липаз-ферментов, расщепляющих жиры:
|
|
|
1. панкреатическая, расщепляет ТАГ на жирные кислоты, глицерин и (3-
моноацилглицерол (β -МАГ).
2. ЛП-липаза (липопротеидлипаза) находится в эндотелии капилляров, служит для
депонирования жиров, расщепляет жиры на жирные кислоты и глицерин.
3. ТАГ-липаза находится в адипоцитах, осуществляет мобилизацию жиров из жировых
депо, расщепляет их на жирные кислоты и глицерин.
Жиры в ротовой полости не перевариваются, в желудке тоже, для переваривания
необходима среда, близкая к нейтральной (создается в результате нейтрализации кислой
среды бикарбонатами кишечника).
Прежде чем расщипиться ферментом поджелудочной железы липазой, жиры должны
быть эмульгированы.
Эмульгирование - это смешивание жиров с водой, происходит под действием солей
желчных кислот, которые являются ПАВ. Обладая амфифильностью (имеют
гидрофильную и гидрофобную части), они встраиваются в жировую каплю своим
гидрофобным концом и снижают ее поверхностное натяжение, в результате жировая
капля распадается на тысячи мелких частей. Это увеличивает поверхность
соприкосновения фермента — липазы со своим субстратом — жиром.
Желчные кислоты.
Синтезируются в печени из холестерина, т. е. в основе их структуры лежит циклопентанпергидрофинантреновое кольцо.
Бывают первичные и вторичные:
-первичные (холевая и хенодезоксихолевая)
Они синтезируются в печени путем гидроксилирования (с участием О2, НАДФН и
цитохрома Р450)затем поступают в желчный пузырь, где они существуют в
видеконъюгатов с глицином или таурином (биогенный аммин), получается гликохолевая
или таурохолевая кислоты.
Т. к. в желчи много натрия и калия, то конъюгаты находятся в виде солей кроме желчных
кислот в желчи содержится ~ 5% холестерина, ~ 15% фосфолипидов, -80% желчных
солей. Если это соотношение повышается в сторону холестерина, то он выпадает в
осадок в виде камней.
Желчные кислоты поступают в желчный пузырь постоянно, а выбрасываются из него в
процессе пищеварения.
-вторичные образуются из первичных под действием микрофлоры кишечника. Из холевой образуется литохолевая, из хенодезоксихолевой - дезоксихолевая кислота. Желчные кислоты способствуют активированию панкреатической липазы и всасыванию продуктов гидролиза жиров. Только 5% желчных кислот выводится из организма, остальная часть всасывается в кишечник, поступает в печень и используется повторно, т. е. циркулирует (энтерогепатическая циркуляция).
|
|
|
На эмульгированные жиры действует панкреатическая липаза, расщепляя сложноэфирные связи в а-положении. Отщепление жирных кислот в р-положении происходит медленнее, следовательно, продуктами гидролиза являются жирные кислоты, глицерин и β -МАГ.
Всасывание продуктов гидролиза.
Глицерин и жирные кислоты с кроткой цепью всасываются самостоятельно, а β -МАГ и жирные кислоты с длинной цепью всасываются при помощи мицелл. Мицеллы - это шаровидные образования, имеющие гидрофобное ядро (β -МАГ, жирные кислоты с длинной цепью, жирорастворимые витамины: А, Д, Е, К) и эфиры холестерины. Гидрофильная поверхность образована желчными кислотами и холестерином. Мицеллы всасываются в тонком кишечнике, в клетках слизистой оболочки кишечника они распадаются на желчные кислоты, холестерин, жирорастворимые витамины: А, Д, Е, К, β -МАГ, жирные кислоты.
Ресинтез в клетках слизистой кишечника. Существует заболевание стеаторрея (жирный кал). Причины:
1. закупорка желчных протоков или фистула желчного пузыря (желчные кислоты не
поступают в кишечник)
2. заболевание поджелудочной железы: жиры эмульгируются, но не расщепляются
липазой, выводятся с калом,
3. нарушение всасывания (диарея)
Ресинтез - это синтез жиров из продуктов гидролиза, в результате чего образуется жир,
характерный для каждого организма, т. к. в состав жира включаются жирные кислоты
собственного организма (эндогенные).
Ресинтез начинается с активирования жирных кислот, идет с участием энергии АТФ,
КоА и фермента ацилКоА синтетазы, активированная форма жирных кислот называется
ацилКоА.
Реакция ресинтеза жиров или ТАГ включает взаимодействие β -МАГ с двумя молекулами активированной жирной кислоты. Ферменты: триацилглицеролсинтетаза, в результате образуется ТАГ, специфические для данного организма.
|
|
|
Ресинтезированные жиры нерастворимы в воде —» в кишечнике образуются транспортные формы жиров - хиломикроны (ХМ), (транспортируют экзогенные или пищевые жиры, имеют гидрофобное ядро и гидрофильную оболочку. Ядро включает в себя ТАГ, эфиры Хс, А, Д, Е, К, поверхность образована монослоем фосфолипидов, полярные головы которых направлены к воде, а неполярные гидрофобные жирнорастворимые хвосты к ядру. На поверхности этих частиц находятся специфические белки - апопротеины). ХМ в кишечнике образуются под действием апопротеина В48. Образовавшиеся ХМ -незрелые. Состав ХМ в процентах: белки - 2%, фосфолипиды -3%, холестерин - 2%,
ЭХс - 3%, ТАГ - 90%—»ХМ - основная транспортная форма жиров. ХМ - большие,
самые крупные из всех липопротеинов, поэтому они не проникают в кровеносные
сосуды, а ХМ незрелые поступают в лимфатические сосуды, потом через лимфатический
проток поступают в сосуды, где превращаются в зрелые ХМ, т. к. получает от
липопротеинов высокой плотности (ЛВП) апобелки С2 и Е.
В дальнейшей судьбе ХМ принимают участие жировая ткань и печень. В крови ХМ
зрелые подвергаются действию ЛП-липазы (фермент, локализованный на поверхности
эндотелия капилляров). Этот фермент узнает ХМ зрелые взаимодействуя с оспобелком
С2, который активирует этот фермент. В результате ТАГ ХМ зрелые гидролизуются
этой липазой на глицерин и жирные кислоты. Глицерин поступает в печень, где
участвует в синтезе эндогенных жиров или фосфолипидов, а жирные кислоты
депанируются в жировой ткани в виде ТАГ, либо окисляется в сердце, в мышцах и
других органах, кроме мозга. В результате действия ЛП-липазы образуются остаточные
ХМ. Они захватываются печенью посредством апобелка энергии и под действием
лизосомальных ферментов распадаются на Хс, ЭХс, А, Д, Е, К, апопротеины и 10% ТАГ.
В кишечнике синтезируется в небольшом количестве другая транспортная форма -
ЛОНП (липопротеины очень низкой плотности), они поступают в кровь, затем в
жировую ткань, где под действием ЛП-липазы из них извлекаются жиры, которые
депонируются, а из ЛОНП в результате извлечения жиров образуются ЛНП, содержащие
до 50% Хс и ЭХс.
ЛНП частично захватываются печенью.
После приема жирной пищи концентрация ХМ и липопротеинов повышается через 4-5
часов (сыворотка мутная или белая), а затем концентрация понижается, т. к. действует
ЛП-липаза. При дефекте ЛП-липазы в крови повышается концентрация ЛОНП и ХМ,
сыворотка остается мутноватой - гиперхиломикронемия или гиперлипопротеинемия.
От жировых депо, где ТАГ распадаются на жирные кислоты и глицерин под действием
|
|
|
ЛП-липазы (или ТАГ-липазы). Жирные кислоты в комплексе с альбумином
транспортируются к органам и тканям, где подвергаются расщеплению с целью
извлечения энергии. Мозг не использует жирные кислоты. Этот процесс называется р-
окисление жирных кислот.
β -окисление - это специфический путь катаболизма жирных кислот до ацетилКоА,
протекает в почках, в мышцах, особенно интенсивно в печени, кроме мозга, в
митохондриях.
Значение процесса - извлечение энергии из жирных кислот. Процесс назван так из-за
окисления группы-СН в р-положении. Процесс циклический, в конце каждого цикла
молекула ЖК укорачивается на 2 углеродных атома в виде ацетилКоА, который
поступает в ЦТК, а укороченная на 2 атома углерода ЖК поступает в новый цикл.
Многократное повторение процесса приводит к полному расщеплению ЖК до
ацетилКоА.
Регуляторный фермент скорость лимитирующий фермент
карнитинацилКоАтрансфераза 1, активируется этот фермент гормоном голода -
глюкагоном. Ингибируется - инсулином и регуляторным ферментом синтеза ЖК
(ацетилКоАкарбоксилаза).
Прежде чем вступить в β -окисление ЖК должна превратиться в активированную форму
- ацилКоА (см. Ресинтез жиров).
Активирование происходит в цитоплазме. Мембрана митохондрий непроницаема для
активированных ЖК, их перенос происходит при участии специфического переносчика
карнитина. Под действием ферментов карнитинацилКоАтрансферазы 1и 2
активированная ЖК присоединяется сложноэфирной связью к спиртовой группе карнитина, образуется комплекс ацилкарнитин. Он диффундирует в митохондрию, где с помощью специфических ферментов ацильная группа с карнитина переносится на КоА. Перенесенная в митохондрии ЖК подвергается β -окислению включая 4 реакции в одном цикле, 2 из них имеют непосредственную связь с ЦПЭ, т. к. это реакции окисления.
В последнем цикле образуется 2 молекулы ацетилКоА.
Подсчет энергии.
Для того, чтобы подсчитать энергетический выход процесса необходимо найти число
ацетилКоА, образующихся при р-окислении и число циклов, необходимых для
расщепления ЖК.
Сп=10
Число ацетилКоА = n/2 — 10/2=5
В данном случае число ацетилКоА = 5 —> ЦТК à 5* 12=60АТФ
Число циклов = п/2 -1=4, т. к. в последнем цикле образуется 2 молекулы ацетилКоА.
В каждом цикле есть 2 реакции окисления:
1- идет с участием НАД —► Р/О = 3
2- идет с участием ФАД —> Р/О — 2, т. е. в каждом цикле за счет водородов от окисляемых
субстратов 1 и 3 реакции, в сопряженном синтезе образуется 5 АТФ, 5*4 = 20 АТФ
Итог: 20 + 60 =80АТФ - 1 АТФ (на активирование ЖК) - 79
79 АТФ выделится при окислении 10-углеродной ЖК.
ЖК с нечетным числом углеродных атомов окисляется аналогично, в последнем цикле
образуется вместе с ацетилКоА пропионилКоА —► в ЦТК энергетический выход будет
немного ниже.
Регуляторный фермент р-окисления активируется в период пониженной концентрации
УВ, а именно, при мышечной нагрузке и в период между приемами пищи. Период после
приема пищи называется абсорбционный, период между приемами пищи -
постабсорбционный.
Биосинтез кетоновых тел.
Кетоновые тела - это β -гидроксимасляная кислота или р-гидроксибутират, ацетоуксусная кислота или ацетоацетат, ацетон (только при патологии). Нормальная концентрация кетоновых тел в крови Змг в 100 мл или 0, 03-0, 05 ммоль/л. Основное кетоновое тело - это β -гидроксибутират.
Синтезируется только в печени, используется организмом в качестве источника энергии, при длительном голодании даже мозгом. Не использует кетоновые тела печень. Субстратом для синтеза является ацетилКоА (получаемый при β -окислении). Часть ацетилКоА поступает в 1ДТК, часть на синтез кетоновых тел. Процесс протекает в митохондриях. В результате синтеза кетоновых тел образуется вещество -промежуточное соединение, которое играет большую роль при синтезе кетоновых тел или Хс - это вещество называется 3-гидрокси-β -метилглутарилКоА (ГМГКоА). 2 молекулы ацетилКоА под действием фермента тиолаза превращается в ацетоацетилКоА. Он под действием фермента 3-гидрокси-β -метилглутарилКоАсинтетазы с участием еще одной молекулы ацетилКоА образует β -гидрокси-β -метилглутарилКоА. Под действием β -гидрокси-β -метилглутарилсинтетазы образуется ацетоацетат. Про патологии происходит декарбоксилирование ацетоацетата с образованием ацетона.
Распад кетоновых тел.
Для того, чтобы кетоновые тела использовались в качестве источника энергии, необходимо активировать ацетоуксусную кислоту. Реакция протекает под действием фермента сукцинилКоАацетоацетаттрансферазы (его нет в печени, поэтому печень кетоновые тела не использует).
Подсчитаем сколько молекул АТФ выделяется при расщеплении ацетоуксусной кислоты - 24 молекулы АТФ. Так как при регенерации сукцината в сукцинилКоА затрачивается 1 АТФ, то общее количество АТФ - 23 молекулы. При окислении β -гидроксибутирата - 3 АТФ + 23 = 26 АТФ выделяется.
При патологических состояниях, таких как сахарный диабет (недостаток инсулина) или при длительном голодании скорость синтеза кетоновых тел резко повышается и концентрация их в крови повышается до 90мг /100мл, а при сахарном диабете - до 140мг/100мл. При этих состояниях образуется ацетон, который выделяется с выдыхаемым воздухом, такое состояние называется кетоз. В результате накопления этих кислот в крови рН сдвигается в кислую сторону и такое состояние организма называется метаболический некомпенсированный ацидоз (помочь можно в/в введении гипертонического раствора глюкозы).
Почему при голодании и сахарном диабете концентрация кетоновых тел резко увеличивается? В условиях длительного голодания и сахарного диабета, когда клетки находятся в состоянии энергетического голода (нет глюкозы) и поэтому —> основным источником энергии в этих условиях становятся ЖК, в составе жиров, депонированных в жировой ткани. Распад жиров активируется глюкагоном (гормон голода), расщепившиеся жиры жировой ткани на глицерин и ЖК, мобилизуются, глицерин идет в печень, а ЖК подвергаются β -окислению во всех органах, кроме мозга. В результате образуется много ацетилКоА, который в норме практически весь поступил бы в ЦТК, но в условиях голодания и сахарного диабета ЦТК тормозится, т. к. оксалоацетат будет использоваться для синтеза глюкозы в глюконеогенезе, необходимой для работы мозга в этих условиях, т. к. мозг ЖК не использует.
Поэтому основное количество ацетилКоА, образующегося при р-окислении, идет на синтез кетоновых тел à их концентрация повышается.
Биосинтез высших ЖК.
Это синтез их из ацетилКоА, полученного при расщеплении углеводов. Протекает в цитоплазме и наиболее интенсивно в печени, в почках, в молочной железе в период лактации. В организме человека синтезируется в основном пальмитиновая кислота (С 16), а в митохондриях гепатоцитов происходит удлинение цепей синтезированных ЖК.
Регуляторная реакция процесса - образование из ацетилКоА малонилКоА под действием фермента ацетилКоАкарбоксилаза, коферментом является биотип или витамин Н. Активируется этот фермент гормоном инсулином, в период достаточного поступления углеводов (много глюкозы —> гликолиз —»ПВК —» много ацетилКоА для синтеза ЖК). Данный регуляторный фермент ингибирует регуляторный фермент β -окисления (карнитинацилтрансферазу).
В синтезе ЖК во всех этапах вместо HSKoA участвует ацилпереносящий белок (АПБ). В двух реакциях будет участвовать кофермент НАДФН, как источник Н в реакциях восстановления (НАДФН из пентозофосфатного пути).
Синтез ЖК «похож» на β -окисление, но наоборот: процесс циклический, но в конце каждого цикла происходит удлинение цепи ЖК на 2 углеродных атома. В конце синтеза пальмитиновой кислоты происходит отщепление АПБ. Процесс синтеза осуществляется пальмитатсинтетазным комплексом. Это доменный белок (состоит из 1 ППЦ, которая в нескольких участках формирует домен, в третичной структуре обладающий ферментативной активностью).
Включает в себя 6 участков, обладающих ферментативной активностью. Все вместе они объединены в АПБ, который связан с фосфопантонеатом (фосфорилированная пантотеновая кислота с SH-группой на конце). На этом конце и протекают все реакции, то есть S не выделяется в среду. Пальмитатсинтетаза имеет 2 функциональные единицы, каждая из которых синтезирует 1 пальмитиновую кислоту.
Строение пальмитатсинтетазного комплекса.
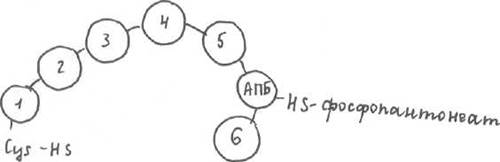
1 фермент - трикетоацилсинтаза
2 - трансацилаза
3 - еноилредуктаза (фермент, у которого в качестве кофермента будет НАДФН)
4 - гидротаза
5 - кетоацилредуктаза (НАДФН+Н+)
6 - тиоэстераза (будет отщеплять синтезированную ЖК от АПБ)
Синтез жиров (ТАГ).
Обмен жиров или ТАГ включает в себя несколько стадий: 1). Синтез жиров (из глюкозы, эндогенные жиры), 2). Депонирование жиров, 3). Мобилизация.
В организме жиры могут синтезироваться из глицерина и из глюкозы. Основные 2 субстрата для синтеза жиров:
1) α -глицеролфосфат (α -ГФ)
2) ацилКоА (активированная ЖК).
Синтез ТАГ происходит через образование фосфатидной кислоты.
α -ГФ в организме человека может образовываться двумя путями: в органах, в которых активен фермент глицеролкиназа, ГФ может образоваться из глицерина, в органах, где активность фермента низкая, ГФ образуется из продуктов гликолиза (т. е. из глюкозы).
Если в реакцию вступает восстановленная форма НАД (НАДН+Н ), то это реакция
восстановления и фермент называется по продукту + «ДГ».
Биосинтез ТАГ наиболее интенсивно протекает в печени и жировой ткани. В жировой
ткани синтез ТАГ протекает из УВ, т. е. часть глюкозы, поступившей с пищей может
превращаться в жиры (когда углеводов поступает больше, чем необходимо для
возобновления запаса гликогена в печени и мышцах).
Жиры, синтезированные в печени (двумя путями) упаковываются в частицы ЛОИП,
поступают в кровь —> ЛП-липазе, которая гидролизует ТАГ или жиры из этих частиц на
ЖК и глицерин. ЖК поступают в жировую ткань, где депонируются в виде жиров, либо
используются как источник энергии органами и тканями (р-окисление), а глицерин
поступает в печень, где может использоваться для синтеза ТАГ или фосфолипидов.
В жировой ткани депонируются жиры, которые образованы из глюкозы, глюкоза дает
оба или 2 субстрата для синтеза жира.
После приема пищи (абсорбционный период) f концентрация глюкозы в крови, |
концентрация инсулина, инсулин активирует:
1. транспорт глюкозы в адипоциты,
2. ЛП-липазу.
—► активирует синтез жира в жировой ткани и его депонирование —> существует 2 источника жиров для депонирования в жировой ткани:
1. экзогенные (ТАГ из хиломикронов и ЛОНП кишечника, переносящие пищевые
жиры)
2. эндогенные жиры (из ЛОНП печени и образующиеся ТАГ в самих жировых
клетках).
Мобилизация жиров - это гидролиз жиров, находящихся в адипоцитах до ЖК и глицерина, под действием гормонзависимой ТАГ-липазы, которая находится в клетках и активируется в зависимости от потребностей организма в источниках энергии (в постабсорбтивном периоде, т. е. в промежутках между приемами пищи, при голодании, стрессе, длительной физической работе, т. е. активируется адреналином, глюкагоном и соматотропным гормоном (СТГ).
При длительном голодании концентрация глюкагона увел., это приводит к снижению синтеза ЖК, увеличению β -окисления, увеличеню мобилизации жиров из депо, увеличен синтез кетоновых тел, увеличен глюконеогенез.
Отличие действия инсулина в жировой ткани и печени:
↑ концентрации инсулина в крови приводит к ↑ активности ПФП, ↑ синтеза ЖК, ↑ гликолиза (глюкокиназа, фосфофруктокиназа (ФФК), пируваткиназа - ферменты гликолиза; глюкозо-6-ДГ - фермент ПФП; ацетилКоАкарбоксилаза - фермент синтеза ЖК).
В жировой ткани активируется ЛП-липаза и депонирование жиров, активируется поступление глюкозы в адипоциты и образование из нее жиров, которые тоже депонируются.
В организме человека существует 2 формы депонированного энергетического материала:
1. гликоген; 2. ТАГ или нейтральные жиры.
Отличаются по запасам и очередности мобилизации. Гликогена в печени от 120-150г, может быть до 200, жиров в норме ~ 10кг.
Гликогена хватает (в качестве источника энергии) на 1 сутки голодания, а жиров - на 5-7 недель.
При голодании и физической нагрузке в первую очередь используются запасы гликогена, затем постепенно нарастает скорость мобилизации жиров. Кратковременные физические
нагрузки обеспечиваются энергией, за счет распада гликогена, а при длительных физических нагрузках используются жиры.
При нормальном питании количество жиров в жировой ткани постоянно, но жиры постоянно обновляются. При длительном голодании и физических нагрузках скорость мобилизации жиров больше, чем скорость депонирования à количество депонированных жиров уменьш. (похудение). Если скорость мобилизации ниже, чем скорость депонирования - ожирение.
Причины: несоответствие между количеством потребляемой пищи и энергозатратами организма, и поскольку мобилизация и депонирование жиров регулируются гормонами —» ожирение является характерным признаком эндокринных заболеваний.
Обмен холестерина. Биохимические основы возникновения атеросклероза. Основные функции холестерина в организме:
1. основная: большая часть Хс используется для построения клеточных мембран;
2. Хс служит предшественником желчных кислот;
3. служит предшественником стероидных гормонов и витамина D3 (половые
гормоны и гормоны коры надпочечников).
В организме на долю Хс приходится основная масса всех стероидов ~ 140г. Синтезируется Хс в основном в печени (-80%), в тонком кишечнике (-10%), в коже (-5%), скорость синтеза Хс в организме зависит от количества экзогенного Хс, если с пищей поступает более 1г Хс (2-3г) синтез собственного эндогенного Хс ингибируется, если Хс поступает мало (вегетарианцы) скорость синтеза эндогенного Хс |. Нарушение в регуляции синтеза Хс (а также образование его транспортных форм —> гиперхолестеринемия —» атеросклероз —> ИБС —► инфаркт миокарда). Норма поступления Хс > 1г (яйца, масло (сливочное), печень, мозг).
Синтез холестерина.
Хс с пищей поступает преимущественно в виде эфиров Хс (Хс этерифицирован ЖК по третьему положению). В кишечнике под действием фермента холестеролэстеразы ЭХс расщепляется на Хс и ЖК. После всасывания в кишечнике Хс этерифицируется и образуются ЭХс. Этот Хс и Хс, синтезированный в кишечнике (10%), встраиваются в хиломикроны (90%) и ЛОНП (10%) —> кровь —> ЛП-липаза. Под действием ЛП-липазы из хиломикронов и ЛОНП извлекаются жиры или ТАГ. Из хиломикронов образуются остаточные хиломикроны —> печень, где из них высвобождается Хс, который используется для синтеза желчных кислот, либо при избыточном поступлении ингибирует синтез собственного Хс, а из ЛОНП образуется ЛНП (содержание Хс, в которых более 50 %). На поверхности ЛНП находится апобелок β 100. ЛНП —> органы и ткани, где клетки узнают ЛНП, за счет β 100.
ЛНП поглощается клетками, содержащийся в них Хс используется для нужд клетки (для построения мембран).
Таким образом, функция ЛНП - снабжение Хс органов и тканей организма. В печени синтезируется собственный Хс, ферменты синтеза Хс имеются во всех клетках, имеющих ядро. Синтезируется Хс из ацетилКоА. Различают 3 этапа:
1. образование мевалоновой кислоты;
2. образование сквалена;
3. образование Хс.
1 этап протекает в цитоплазме, а остальные метаболиты не растворимы в воде à 2иЗ этапы протекают в мембранном слое ЭПР.
1 стадия похожа на синтез кетоновых тел. Регуляторная реакция - образование мевалоновой кислоты, катализируется регуляторным ферментом. ГМГ-редуктазой, она необратима, скорость лимитирующая. Этот фермент регулируется:
1. аллостерически, по механизму обратной отрицательной связи Хс или его
производными, ингибируется фермент экзогенным Хс, поступающим с пищей (более 1г в
сутки), желчными кислотами, активируется инсулином, эстрогенами,
2. изменяется количество фермента, которое контролируется на уровне экспрессии гена.
Биосинтез Хс.
На синтез одной молекулы Хс (С27 необходимо 18 молекул АТФ и 18 молекул ацетилКоА.
2 стадия: мевалоновая кислота превращается в сквален.

3 стадия

сквален
холестерин
Синтезируемый в печени Хс упаковывается в ЛОНП вместе с жирами, которые
поступают в кровь, из них образуются ЛНП, которые снабжают Хс органы и ткани. Как
предотвратить накопление Хс в органах и тканях?
Этому способствуют другие транспортные частицы: ЛВПЗ, которые синтезируются в
печени и содержат небольшое количество Хс. Они поступают в кровь, взаимодействуют
с ЛНП либо с клетками тканей —> кровь, забирают избыток Хс из них.
Функционирование ЛНП и ЛВП поддерживает гомеостаз Хс в клетках.
Каким образом ЛВП забирают избыток Хс из других липопротеинов, органов и тканей?
Это связано с присутствием на поверхности ЛВПЗ фермента, который называется
лицетинХсацилтрансфераза (ЛХАТ). Здесь же на поверхности присутствует его
кофактор - А1. Этот фермент отщепляет ЖК от фосфолипидов на поверхности ЛВПЗ и
переносит ее на гидроксильную группу Хс.
В результате образуются ЭХс.
ЭХс - гидрофобные, погружаются внутрь ЛВПЗ.
Концентрация Хс на поверхности снижается и освобождается место для Хс и других
частиц.
|
|
|
|
Таким образом ЛВПЗ извлекают Хс из мембран клеток. В результате образуется ЛВП2 с
большим содержанием Хс —> печень, там распадается.
Хс используется для синтеза желчных кислот. В конечном итоге избыток Хс выводится с
желчью, либо в виде свободного Хс, либо в виде желчных кислот. Около 1г Хс
выводится из организма с фекалиями. 50% в составе желчи, в виде желчных кислот и
50% в виде капростенола, который образуется из Хс в нижних отделах кишечника под
действием микрофлоры.
Нарушение баланса между ЛНП и ЛВП может привести к липопротеинемиям. Например,
гиперхиломикронемия (дефект ЛП-липазы), гиперхолестеринемия (нарушение
поглощения ЛНП клетками), увел. концентрации Хс - основной патогенетический фактор
развития атеросклероза.
Главное проявление: отложение Хс в стенках в основном, крупных сосудов.
Предрасположенность к нему считается по коэффициенту атерогенности.
ЛНП еще называют атерогенными.
Для возникновения атеросклероза имеют значение первичные повреждения кровеносных
сосудов: при гипертонии, воспалительных процессах, сахарном диабете, нарушении
свертываемости, действии токсических веществ (например, курении). В результате
нарушается барьер проницаемости сосудов (повышаются промежутки между
эндотелиальными клетками, в эти области проникают ЛНП, которые поглощаются
макрофагами, все компоненты ЛНП разрушаются лизосомальными ферментами, кроме
Хс) —> Хс накапливается, инкапсулируется соединительной тканью, образуется
атеросклеротическая бляшка, в которую могут откладываться соли Са.
В результате стенки сосудов деформируются, сужается их просвет. При атеросклерозе
поток ЛНП в клетке преобладает.
Профилактика атеросклероза.
Диета и потребление ненасыщенных жирных кислот, которых много в растительном масле. N Хс = 3, 6 - 6, 4 ммоль/л, человек должен стремиться к значению 5, 5 ммоль/л.
Обмен нуклеотидов план:
1. переваривание нуклеиновых кислот (НК)
2. синтез пуриновых нуклеотидов
3. синтез пиримидиновых нуклеотидов
4. катаболизм пуриновых нуклеотидов
5. катаболизм пиримидиновых нуклеотидов
6. синтез дезоксирибонуклеотидов
1. Ни нуклеотиды, ни пуриновые основания исходные, поступившие с пищей, не
включаются в НК тканей человека, а также не в пуриновые и пиримидиновые
коферменты (НАД, ФАД, КоА).
В организме человека нуклеотиды, необходимые для синтеза НК, синтезируются заново или деново.
Нуклеотиды поступают в организм, в составе НК, а НК в составе нуклеопротеинов (икра, печень, молока, почки, рыба, шоколад, кофе, какао, чай, красное вино, мясо, яйца, молоко, сыр - практически нет).
Под действием фермента поджелудочной железы рибонуклеазы и дезоксирибонуклеазы расщепляют 3, 5-фосфодиэфирные связи и НК расщепляются до нуклеотидов. Нуклеотидазы и фосфатазы гидролизуют нуклеотиды до нуклеозидов. Нуклеозиды либо всасываются, поступают в печень, где подвергаются катаболизму, либо небольшое количество расщепляется до пуриновых и пиримидиновых оснований в слизистой кишечника под действием фосфатазы, здесь же могут окисляться, т. е. расщепляться до конечных продуктов, которые всасываются и затем выводятся с мочой.
2. Синтезируются пуриновые и пиримидиновые нуклеотиды из СО^, аспарагиновой
кислоты, глутамата, глицина и рибозы.
Путь синтеза пуринов завершается образованием икозин-5-монофосфата, который затем превращается в АМФ и ГМФ. Конечный продукт синтеза пиримидинов-УМФ, который является предшественником других пиримидинов. В обоих синтезах участвует ТГФ (Н4-фолат), как переносчик одноуглеродных фрагментов. Азотистые основания синтезируются из простых соединений, донорами С и N служат:
 глицин
глицин
Для пуриновых нуклеотидов существует 2 пути:
1. сборка из мелких фрагментов
2. из азотистых оснований, полученных при катаболизме (20% от общего синтеза,
называется «путь спасения»)
Синтез включает много реакций:
|
|
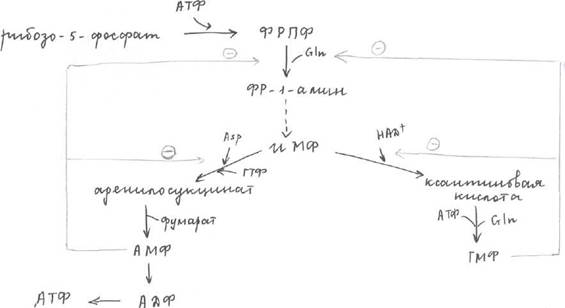
ПФП поставляет нам рибозо-5-фосфат, который под действием АТФ и 1 фермента превращается в фосфорибозилпирофосфат, который под действием второго фермента и амидной группы глутамина превращается в фосфорибозил-1-амин. ИМФ - инозинмонофосфат ТМФ - гуанозинмонофосфат
Ферменты.
1 - ФРПФ синтетаза (фосфорибозилпирофосфатсинтетаза)
2 - регуляторный (амидофосфорибозилтрансфераза)
3-ИМФ-ДГ
4 - ГМФ-синтетаза
5 - аденилосукцинатсинтетаза
6 - аденилосукциназа.
Регуляция синтеза нуклеотидов.
Основную роль в регуляции играет ретроингибирование - снижение скорости синтеза нуклеотидов при достижении их достаточной концентрации в клетки за счет аллостерического ингибирования ключевых ферментов.
Если в клетке много пуриновых и пиримидиновых нуклеотидов, то тогда по принципу ретроингибирования ингибируется 2.
Если АМФ синтезировано больше чем ГМФ соответственно будет ингибироваться 5 и 3 ферменты. Избыточная [ГМФ] ингибирует 3 фермент. Второй путь синтеза пуриновых нуклеотидов.
Протекает из готовых азотистых оснований, полученных при катаболизме, этот путь спасает организм от избытка образования мочевой кислоты.
Генетический дефект этого фермента Е2 приводит к заболеванию: синдром Леша-Нихана (болеют только мужчины): агрессивность, мазохизм.
Синтез пиримидиновых нуклеотидов.
В синтезе пиримидиновых нуклеотидов 6 реакций, 3 фермента, в цитоплазме, итогом синтеза является образование УМФ - предшественник остальных нуклеотидов. Регуляторный фермент 1 катализирует 1, 2 и 3 реакции, полифункциональный, называется карбамоилфосфатсинтетаза 2. Дегидрооротат ДГ. Оротатфосфорибозилтрансфераза 5 Оротатфосфорибозилдекарбоксилаза.
Регуляция.
Регуляторный фермент активируется АТФ и ГТФ. УТФ и ЦТФ ингибируют синтез.
Глутамин – CO2, H2O à карбомоилфосфат –Aspà карбомоиласпартатà дигдрооротат—NAD+à оротатà ОПФà УМФà УДФà УТФà ЦТФ
Наиболее известным нарушением синтеза пиримидинов является оротатоцидурия -повышенное выделение с мочой продукта неполного синтеза пиримидинов оротата (оротовая кислота).
В результате генетических дефектов ферментов 5 и 6. Кислота накапливается в органах и тканях, увеличивается содержание в моче. Для детей: отставание в развитии, мегалобластическая анемия, «оранжевая кристаллоурия» из-за кристаллов, имеющих оранжевый цвет. Используют для лечения уридин.
Катаболизм.
Катаболизм пиримидиновых нуклеотидов протекает до полного расщепления пиримидиновых колец. Не имеет специфических конечных продуктов обмена. Конечными продуктами цитозина являются СО2, NH3 и β -аланин; урацила - NH3; тимина - β -аминоизобутират.
Катаболизм пуриновых нуклеотидов.
Включает реакции гидролитического ра
|
|
|