|
Гемостаз. Фибрина. БИОХИМИЧЕСКИЙ_АНАЛИЗ
|
|
|
|
5)
В цитоплазме находится белок цАМФ - зависимая или акиназа, активность которой зависит от присутствия второго посредника. Она состоит из двух субъединиц: регуляторной и каталитической, которые соединены вместе. Не обладает ферментативной активностью.
При взаимодействии цАМФ с регуляторной субъединицей происходит отсоединение каталитической субъединицы, она меняет свою конформацию и активируется; приобретает способность фосфорилировать или дефосфорилировать белки (ферменты, ионные каналы) за счет концевой фосфатной группы АТФ. Акиназа обеспечивает второе усиление сигнала, т. к. фосфорилирует несколько белков. После активации акиназы избыток цАМФ разрушается под действием фермента фосфодиэстеразы до АМФ. цАМФ—► АМФ
Эффекты, осуществляемые через ц АМФ.
1. через цАМФ гипоталамические либерины (рилизинг-факторы) действуют на
секреторный ответ аденогипофиза: АКТГ, ФСГ, ТТГ
2. через цАМФ увеличивается проницаемость для воды в собирательных трубочках
под действием АДГ.
3. через цАМФ происходит мобилизация и депонирование жиров, распад гликогена,
изменяется функционирование ионных каналов в постсинаптических мембранах.
цГМФ - присутствует в клетках в меньшем количестве. цГМФ образуется аналогично см. предыдущий каскад. ГЦ - гуанилатциклаза.
цГМФ вызывает эффекты противоположные цАМФ. Например, в сердечной мышце адреналин стимулирует образование цАМФ, ацетилхолин - цГМФ, т. е. оказывают противоположные действия. Адреналин увеличивает силу и частоту сердечных сокращений. Активность цГМФ зависит от присутствия ионов Са. Через цГМФ действует Na-уретический пептид. Также оксид азота NO, который находится в эндотелии капилляров и способен релаксировать (расслаблять их через цГМФ)
|
|
|
Кальций как вторичный посредник.
Действие Са как второго посредника связано с повышением концентрации Са2+ цитоплазме. Концентрация Са может увеличиваться двумя способами:
1. из внутриклеточных депо, например, саркоплазматический ретикулум
2. поступление Са внутрь через управляемые мембранные каналы.
Из внутриклеточных депо Са может высвобождаться под действием инозитол-3-фосфата и в ответ на деполяризацию мембраны, т. е. электрическим стимулом кратковременно открываются кальциевые потенциалзависимые каналы. В некоторых тканях, например, в сердечной мышце число каналов изменяется в результате фосфорилирования белков мембранных каналов цАМФ - зависимой протеинкиназой. Кальциевые каналы активируются химическим способом. Пример, в печени и в слюнных железах приток Са наблюдается при активации а-адренергических рецепторов адреналина. Большая часть Са связывается с белками, небольшая часть находится в ионизированной форме. В клетке существуют специфические белки, такие как кальмодулин или гуанилатциклаза. Они обладают особенностями:
1. у них есть специфические участки связывания с ионами Са, обладающие высоким сродством к Са (даже при низких концентрациях Са)
2. при взаимодействии с Са2+ они меняют свою конформацию, могут активироваться и вызывать различные аллостерические эффекты.
Каскад - это цепь биохимических реакций, приводящих к усилению первоначального сигнала.
Специфические кальциевые каналы плазматической мембраны или ЭПР активируются различными стимулами. В результате ионы Са1+—> внутрь по градиенту —> [Са] увеличивается до 10- 10 моль. Повышение Са активирует несколько путей внутриклеточной регуляции:
1. Са взаимодействует с кальмодулином, затем происходит активация Са -
кальмодулинзависимой протеинкиназы. Она переводит белки из неактивного в
активное состояние, что приводит к различным клеточным ответам. Пример: в
гладких мышечных волокнах может фосфорилировать легкие цепи головки
миозина, в результате чего она присоединяется к актину, возникает сокращение.
|
|
|
2. Са может активировать мембранную гуанилатциклазу и способствовать
выработке второго посредника цГМФ
3. ионы Са могут активировать С-киназу, тропонин С в поперечно-полосатых
мышцах и другие Са-зависимые белки (глицерол - 3 - фосфатДГ)(гликолиз),
пируваткиназа (гликолиз); пируваткарбоксилаза (глюконеогенез)
Мембранные липиды в роли вторичных посредников. Общие черты с предыдущими:
1. присутствует G-белок;
2. присутствует фермент, усиливающий сигнал.
Особенность: фосфолипидный компонент мембраны сам служит фосфорилированным
предшественником для образования молекул-посредников. Этот предшественник
находится в основном на внутренней половине билипидного слоя и называется
фосфатидилинозитол-4, 5-бифосфат.
Гормон взаимодействует с рецептором, образовавшийся ГР-комплекс, влияет на G-белок,
способствуя его связыванию с ГТФ. G-белок активируется и может активировать
фосфолипазу, катализирующую гидролиз фосфатидилинозитол-4, 5-бифосфат на вторых
посредника: диацилглицерол (ДАТ) и инозитол-3-фосфат.
Диацилглицерол-гидрофобный, может перемещаться путем латеральной диффузии и
активировать мембранносвязанную С-киназу, для этого рядом должен находиться
фосфатидилсерин. С-киназа способна фосфорилировать белки, переводя их из
неактивного в активное состояние. ИФЗ растворим в воде —> цитоплазма, здесь он
стимулирует высвобождение Са из внутриклеточных депо, т. е. ИФЗ высвобождает
третьего посредника ионов Са.
См. Са - как второй посредник.
Ионы Са активируют С-киназу, способствуя ее связыванию с мембраной.
Вне связывания с мембраной она неактивна.
Эффекты действия:
- АКТГ в коре надпочечников через ИФЗ,
- ангиотензин II
- ЛГ в яичниках и клетках Лейдига.
БИОХИМИЯ ПЕЧЕНИ
План:
1. Роль печени в обмене белков, жиров и углеводов (самостоятельно)
2. Обезвреживающая функция печени
а) микросомальное окисление
б) конъюгация с глюкуроновой и серной кислотой
3. Катаболизм тема, образование желчных пигментов
|
|
|
Обезвреживающая функция печени
1) синтезирование вещества, используемого в других органах: белки плазмы,
глюкоза, кетоновые тела, жиры, холестерин.
2) биосинтез мочевины как конечного продукта азотистого обмена.
3) пищеварительная, синтез желчных кислот, образование и секреция желчи.
4) выделительная. Выделение продуктов обмена веществ через желчь в кишечник.
5) обезвреживание токсических веществ как собственных, так и поступающих
извне - ксенобиотиков (вещества, поступающие в организм и не используемые ни
в энергетических, ни в пластических целях).
Обезвреживание веществ
Если токсическое вещество гидрофобное, то обезвреживание протекает в две стадии. Если гидрофильное, то в одну (во вторую).
1. химическое изменение гидрофобных веществ, в результате они становятся
гидрофильными (окисление, восстановление, гидролиз). Образуются ОН-, СООН,
NH2 - группы.
2. к гидрофильным группам присоединяются различные вещества, в результате
вещества становятся парными и нетоксическими.
1 фаза протекает в микросомах печени (это глыбки эндоплазматической сети),
содержащих системы переноса электронов, которые используют молекулярный
кислород для окисления органических молекул путем присоединения одного или
обоих атомов кислорода к субстрату.
Системы, осуществляющие присоединение обоих атомов кислорода, называются
диоксигеназы (расщепляют гидроксилированные ароматические кольца).
Системы, осуществляющие присоединение одного атома кислорода, называются
монооксигеназы, гидроксилазы.
Второй атом кислорода используется преимущественно для окисления НАДФН до
воды. Монооксигеназы находятся в коре надпочечников, семенниках, яичниках,
плаценте, где они участвуют в биосинтезе стероидных гормонов (на внутренней
мембране митохондрий).
Оксигеназы и гидроксилазы функционируют вместе с флавопротеидами,
цитохромами, отличными от цитохромов ЦПЭ, и объединяются в короткие цепи
переноса электронов.
|
|
|
Отличие этих цепей от ЦПЭ
В отличие от ЦПЭ микросомальные цепи используют кислород в пластических целях и осуществляют гидроксилирование.
Лучше всего изучена цепь гидроксилирования неполярных веществ: она включает в себя цитохром Р45о и белок, содержащий негемовое железо (в надпочечниках он называется адренодоксин).
В результате гидроксилирования токсическое вещество становится более полярным, лучше растворяется в воде и подвергается дальнейшим превращениям.
2 фаза: реакции конъюгации (наиболее распространены реакции с глюкуроновой и серной кислотой).
Донор глюкуроновой кислоты - УДФ-глюкуронат (активная форма глюкуроновой кислоты, глюкуроновая кислота — это производное глюкозы, окисленной по
 спиртовой группе. Фермент - УДФ-глюкуронилтрансфераза).
спиртовой группе. Фермент - УДФ-глюкуронилтрансфераза).
| + Н2О + НАДФ |
бензол+О2+НАДФН+Н+
à
В печени:
фенол (токсическое, но полярное, может подвергаться следующим преобразованиям)
|
|
Фенол + УДФ-глюкуронат à
нетоксическое, парное, выводится из организма
Подобным образом обезвреживаются лекарственные вещества после оказания ими
действия.
Пример: фенобарбитал - снотворное и обезболивающее, подвергается
гидроксилированию монооксигеназой, последующей конъюгацией с
глюкуроновой кислотой.
Аспирин выводится из организма после конъюгации с глюкуроновой кислотой
или глицином. Кроме чужеродных веществ обезвреживанию подвергаются
продукты собственного катаболизма.
Например, продукты распада гема -простетической группы гемоглобина. До 80%
всего гема находится в гемоглобине, остальная часть в геминовых ферментах,
следовательно, обмен гема отражает состояние обмена гемоглобина.
Продолжительность жизни эритроцитов - 110-120 дней, после этого они
фагоцитируются клетками РЭС (селезенка, печень, красный костный мозг, где они
подвергаются разрушению).
Гем, освободившийся после распада гемоглобина, повторно не используется. Он
распадается на железо и желчные пигменты, они выводятся из организма
(задерживается небольшая часть, а железо с помощью белка плазмы трансферрина
поступает в депо - красный костный мозг).
Деградация гема осуществляется микросомальной гемооксигеназой, в реакции
используется кислород и НАДФН+ЕГ, в результате гем дециклизуется, а железо и
■
глобиновая часть сохраняется. Оксигеназа специфически расщепляет а-метеновые мостики, при этом метеновый атом углерода окисляется, образуется зеленый вердоглобин. После этого спонтанно отщепляется железо и глобин, образуется биливердин (зеленый). Отщепленная белковая часть подвергается гидролизу до аминокислот, которые используются повторно. Биливердин под действием фермента НАДФН-зависимой биливердинредуктазы восстанавливается до билирубина (желтый). Образование билирубина можно проследить на синяке. Билирубин транспортируется в РЭС в комплексе с альбумином, затем в печень, где он обезвреживается путем конъюгации с двумя молекулами глюкуроновой кислоты с образованием диглюкуронида билирубина под действием УДФ-глюкуронилтрансферазы.
|
|
|
Болезни, связанные с наследственными изменениями фермента
УДФ-глюкуронилтрансферазы
1. желтуха - синдром Криглера - Найара - генетическое изменение фермента
УДФ-глюкуронилтрансферазы приводит к гибели в течение первого года жизни-
нарушение конъюгации билирубина.
2. хроническая желтуха - синдром Джонсона — нарушение конъюгации
билирубина со второй молекулой глюкуроновой кислоты, следовательно,
нарушается секреция желчи.
Стр. 507
Образовавшийся диглюкуронидбилирубин не токсичен ---------------------------------------- ► желчь -------------- ►
кишечник. В кишечнике конъюгаты билирубина гидролизуются р-глюкуронидазой (фермент бактерий), в результате отщепляется глюкуроновая кислота. Образовавшийся билирубин восстанавливается по метеновым мостикам с образованием стеркобилиногенов и уробилиногенов. Небольшая часть уробилиногена идет в кровь, затем в печень, где расщепляется до ди- и трипирролов. Основная часть уробилиногена и стеркобилиногена выводится с калом, частично почками. Они бесцветные, а в кале и в выпавшей моче окисляются кислородом до уробилина и стеркобилина, имеющих желтый цвет. Продукты превращения билирубина называются желчными пигментами. Желчные пигменты являются компонентами желчных камней. Концентрация билирубина в крови - 8-20 мкмоль/л.
Определение концентрации желчных пигментов в крови и моче применяется для диагностики желтух, определяется прямой (конъюгированный с глюкуроновой кислотой) и непрямой (неконъюгированный) билирубин.
Желтуха - это накопление желчных пигментов в плазме крови в количествах достаточных, чтобы придать желтую окраску коже и конъюктиве.
| Название желтухи | Причины возникновения | Биохимические показатели продуктов обмена билирубина | ||
| кровь | Моча | кал | ||
| 1. гемолитическая | Усиленный распад ЭЦ со скоростью, превышающей способность печени улавливать билирубин из циркуляции (из крови). | ↑ непря-мого билирубина | ↑ уроби-лина | ↑ уроби-лина и стеркоби- лина |
| 2. паренхиматозная или печеночно-клеточная | Повреждение клеток печени вирусами, токсическими гепатотропными соединениями (гепатит, цирроз). Нарушается способность образовывать конъюгаты билирубина и секретировать их в желчь. | ↑ прямого и непрямого билирубина | Появление прямого билирубина ↓ уробилина | ↓ ↑ выделения стеркобилина фекалии светлые |
| З. обтурацион-ная или механическая | Механическое нарушение оттока желчи в кишечник | ↑ ↑ прямого и непрямого билирубина | ↑ ↑ прямого билирубина | Отсутствие Желчных пигментов, цвет глины |
Желтуха у новорожденных: у плода и новорожденных количество ЭЦ в расчете на единицу массы больше, чем у взрослых, больше концентрация гемоглобина в ЭЦ. В течение нескольких недель после рождения количество гемоглобина в крови приближается к таковому у взрослых. Скорость распада ЭЦ выше, чем в последующее время, а способность печени удалять билирубин выражена еще слабо, поэтому в первые недели жизни концентрация билирубина высокая.
БИОХИМИЯ КРОВИ
Кровь- ткань, клетки которой циркулируют в замкнутой системе сосудов. Кровь и лимфа - сформировавшиеся эволюционно совершенные формы коммуникации. Они облегчают контакты с внешней средой и между тканями организма. Фундаментальная роль - поддержание гомеостаза. В медицинской практике кровь - важнейший объект для биохимических исследований.
Основные биохимические и физиологические функции крови:
1. дыхательная (транспорт О2 от легких к тканям, транспорт СО2)
2. питательная (транспорт поглощенных питательных, минеральных,
биологически активных веществ)
3. транспорт экзогенных метаболитов, регуляция метаболизма
4. доставка конечных продуктов обмена веществ в почки, кожу, кишечник для
элиминации
5. поддержание в организме нормального кислотно-щелочного равновесия
6. обеспечение постоянства концентрации Н+ или постоянства рН, который
является основным фактором регуляции ферментативной активности
7. распределение тепловой энергии с целью поддержания нормальной
температуры тела
8. иммунная защита (лейкоциты и антитела).
Белки плазмы крови
Концентрация белков плазмы у взрослых людей - 57-81 г/л (СИ).
Белки плазмы - это сложная смесь, которая включает простые белки, а также
различные сложные конъюгированные молекулы (гликопротеины,
фосфопротеины).
Основными методами разделения смеси на индивидуальные белки являются
использование растворителей/электролитов. В результате удается выделить 3
основные группы белков плазмы:
1. фибриноген
2. альбумин
3. глобулин
Наиболее простым и удобным методом разделения белков является электрофорез:
1. на бумаге удается получить 5 фракций
- альбумин
- α 1-глобулин
- α 2-глобулин
- β -глобулин
- γ -глобулин
2. в крахмальном геле и иммуноэлектрофорез позволяют разделить белки плазмы
на большее количество фракций (9-13)
Электрофоретический анализ белков представляет ценность при постановке диагноза-»планировка лечения. Например, при множественной миеломе резко повышается концентрация глобулинов класса А. При нефрозе снижается общий белок и альбумины, повышаются α 1 и α 2- глобулины. При циррозе печени уменшается общий белок и альбумины, увел. у-глобулины. При хроническом ревматоидном артрите увел. β - и у-глобулины.
Сывороточный альбумин
Синтезируется в печени и его единственная ППЦ состоит из 610 аминокислот и имеет 17 S-S связей. Это один из немногих белков плазмы, который не является гликопротеином. Имеет наименьшую молекулярную массу и наиболее подвижен при электрофорезе. Наиболее важной функцией является то, что этот белок вносит наиболее существенный вклад во внутрисосудистое осмотическое давление (75-80%). При гипоальбуминемии (заболевание печени и почек)—> отек мягких тканей.
Шок, как и отек, часто встречающийся клинический синдром. При травмах и после тяжелых операций капилляры становятся проницаемыми для белков плазмы, они выходят в межклеточное пространство —> много жидкости с
альбумином —> умен. объем крови, поступление ферритина из печени, -умен. АД, гипоксия. Выздоровление часто не наступает при введении жидкости -необратимый шок.
Кроме участия в поддержании осмотического давления альбумин является молекулой - переносчиком. Он транспортирует различные нерастворимые в воде вещества и необходим для нормального обмена жиров. Важна роль в переносе высших жирных кислот из печени в периферические ткани. При нарушении обмена - альбуминемии – умен. - концентрация альбумина, транспорт жирных кислот нарушен, а уровень ЛП увел., холестерина, фосфоглицерола. Альбумин связывает билирубин —> в печень. Концентрация Са2+ в плазме, стероидных гормонов и триптофана регулируется в определенной степени в результате их связывания с альбумином. Многие лекарства (пеницилин, аспирин) образуют прочные комплексы с альбумином.
Глобулины
Гетерогенная сложная смесь белков, нерастворимых в воде. По химической природе они гликопротеины.
α -глобулины
Наиболее изучены функции:
1. ретинолсвязывающий белок (транспорт ретинола) образует эквимолярный
комплекс с преальбумином, который функционирует одновременно как Туг-
связывающий белок. Образование комплекса имеет биологический смысл-
предотвращение экскреции почками ретинолсвязывающего белка.
2. α 2 - глобулин (церуллоплазмин): содержит 0. 34% по массе меди. Для
связывания одно- и двухвалентной меди в молекуле имеется δ -участок. Будучи
медиатором транспорта меди поддерживает ее нормальный уровень в тканях
(печени).
Доказана ферроксидазная и полиаминооксидазная активность глобулина. У
больных с наследственной болезнью Вильсона уровень церуллоплазмина умен., при этом концентрация свободной меди увел. (особенно в печени и мозге)-»неврологические расстройства и поражения печени. Аналогично при хронических и острых отравлениях медью.
3. гаптоглобин составляет 1/4 всех α 2 - глобулинов. Образует специфические
стабильные комплексы с гемоглобином (1: 1). В организме такие комплексы могут
образоваться в результате внутрисосудистого гемолиза эритроцитов.
Биохимический смысл - высокая молекулярная масса, которая препятствует
экскреции белков с почками и защита самих почек от повреждения их
гемоглобином. Снижается концентрация гаптоглобина у больных с
гемолитической анемией.
β -глобулины
Фракция включает различные белки, в том числе липопротеины. Главный компонент - трансферрин, Мг=77500, ИЭТ=5. 5. Этот белок составляет «3% от всех белков плазмы. Функция: связывание и транспорт Fe3+ в различные ткани (в РЭС). Может взаимодействовать с Си и Zn. Осуществляет регуляцию свободного железа в плазме, предотвращает избыточное накопление железа в тканях и потерю его с мочой. Может связывать 2Fe 3+ только в присутствии СО2. У
здоровых людей 1/3 трансферрина насыщена Fe3 +. При беременности, у больных с дефицитом железа – увел. концентрация трансферрина в плазме.
γ - глобулины
Иммуноглобулины, синтезированные Вл или плазмоцитами. Антитела с высокой специфичностью связываются с антигенными детерминантами других молекул. Все молекулы Ig состоят из двух идентичных легких цепей (L), Мг=23000 и двух тяжелых цепей (Н), Мг=53000-75000. У человека 5 основных классов иммуноглобулинов.
Обмен железа
1. Fe входит в состав гемсодержащих белков (гемоглобин, миоглобин), а также
металл флавопротеинов, FeS - содержащих белков (в ЦПЭ), трансферрина и
ферритина.
2. источники Fe при биосинтезе перечисленных белков - это пищевые продукты и
вода, всасывается ~10% Fe пищи. Другой источник - это железо, которое
повторно используется из гемоглобина.
3. кислая среда желудка и присутствие в пище аскорбиновой кислоты
способствуют высвобождению железа из органических солей пищи.
4. поступление Fe из энтероцитов в кровь зависит от скорости синтеза в них белка
апоферритина, который улавливает Fe в клетках слизистой оболочки кишечника и
превращается в ферритин, он остается в энтероцитах.
Биологический смысл: это снижает поступление железа в капилляры из клеток кишечника. При недостатке железа в организме апоферритин практически не синтезируется, когда потребности в железе не велики скорость биосинтеза апоферритина повышается.
5. фермент крови ферроксидаза или церуллоплазмин окисляет двухвалентное
железо, затем оно связывается с трансферрином, который транспортируется с
кровью.
6. трансферрин взаимодействует со специфическими рецепторами и поступает в
клетку. При снижении концентрации железа в клетках скорость синтеза
ферментов снижается и наоборот.
7. ферритин играет роль депо Fe в клетках печени, селезенке и костном мозге.
8. избыток железа аккумулируется в печени и других тканях в составе
гомосидерина - комплекса белков, полисахаридов и Fe3+, который плохо растворим в воде и содержит ~3% Fe.
Накопление гранул гомосидерина в ретикулоэндотелиоцитах печени и селезенки может привести к нарушению функций этих органов.
Особенности метаболизма эритроцитов
1. В результате дифференцировки эритроциты теряют ядро, рибосомы,
митохондрии и эндоплазматический ретикулум.
2. очень важную роль в эритроцитах играет метаболизм глюкозы, который
представлен анаэробным гликолизом и реакциями ПФП
3. высокое содержание кислорода в эритроцитах вызывает повышение скорости
образования супероксидного аниона О2-, H2O, ОН-.
О образуется в ходе одноэлектронного окисления молекулярным кислородом восстановленного флавина, например в составе фермента ксантинДГ.
02- также образуется при одноэлектронном окислении О2 восстановленного компонента дыхательной цепи:
Е-Н2+ О2-> Е-Н + О2 + Н + Этот ионный радикал может восстанавливать окисленный цитохром с:
цитохром с (Fe )—»цитохром с (Fe )
Удаление супероксида может осуществляться специфическим ферментом суперокси дд исмутазой:
О2-+ О2- + 2Н+ à H2O2
В этой реакции Од выступает одновременно как восстановитель и как окислитель. Биохимическое действие O2- в тканях обычно усиливается в результате инициирования цепной реакции образования свободных радикалов. Основная функция супероксиддисмутазы по всей вероятности является в зашите аэробных организмов от повреждающего действия O2- Постоянным источником образования активных форм О2 в эритроцитах является неферментативное окисление гемоглобина.
Hb(Fe2+)+ О2 à Hb(Fe2+ )+ О2-
Активные формы О2 оказывают повреждающее действие на мембраны эритроцитов и могут вызывать гемолиз.
Биохимические системы защиты от активных форм кислорода Гликолиз обеспечивает синтез АТФ и самое главное восстановленных НАДФН, которые являются коферментом метгемоглобинредуктазы. Супероксиддисмутаза
Полученная в результате этой реакции H2O2 под действием ферментов глутатионпероксидазы и катал азы превращается в H2O и O2. При этом донором водорода является восстановленный глутатион. Окисленный глутатион восстанавливается глутатионредуктазой, коферментом которой является НАДФН. Природные естественные антиоксиданты (токоферрол, аскорбиновая кислота) При генетическом дефекте глюкозо-6-фосфатДГ, а также при приеме некоторых лекарств, которые являются сильными окислителями, потенциал глутатионовой защиты может оказаться недостаточным, что приводит к увеличению в клетке активных форм O2, и соответственно окислению гемоглобина (SH-группы). Образование S-S связей между протомерами НЬ и метНЬ приводит к их агрегации и образованию телец Хайнца и вызывает разрушение эритроцитов. Кроме активных форм кислорода возникновение цепных реакций образования органических радикалов могут вызывать металлы с переменной валентностью. Инициация цепной реакции
R-COOH + Ме(n)> ROO~ + Me (n-1)-H+
В дальнейшем происходит развитие реакций с образованием смеси различных органических радикалов и перекисных соединений, которые способны повреждать ненасыщенные липиды ((3-каротин, ретинол).
Гемоглобин Формы гемоглобина:
1) дезоксигемоглобин (восстановленный) - это НЬ, не связанный с кислородом и содержащий гем с ферроионом (Fe2+)
2) оксигемоглобин - полностью оксигенированный НЬ (НЬОд, ) содержит 4
молекулы О^на 1 молекулу НЬ
3) карбоксигемоглобин (НЬСО) связывает 4 молекулы СО
НЬ может связывать 4 молекулы NO - HbNO
Различные пероксиды, феррициониды, ионы азотистой и мышьяковистой кислот, хиноны могут окислять Fe до Fe f^- получают метНЬ, который не присоединяет ни О^, ни СО.
20 - 30% метгемоглобина - сильная интоксикация организма, > 60% -несовместимо с жизнью.
Конверсия метгемоглобина
Конверсия метНЬ in vivo может быть осуществлена гидросульфидом натрия, также рассматривается роль глутатионовой кислоты, восстановленных нуклеотидов и аскорбиновой кислоты.
Биомедицинское значение гемоглобина Установлена молекулярная основа ряда генетических заболеваний, например:
1) серповидно - клеточная анемия возникает в результате изменения свойств
поверхности (3 - субъединиц НЬ, в результате полимеризации дезоксиНЬ серой,
образуются спиральные фибриллярные структуры. При этом каждая молекула
гемоглобина контактирует с 4 соседними молекулами. Образование подобных
трубчатых волокон ответственно за повреждение содержащих их эритроцитов,
которые приобретают серповидную формую Становятся подвержены лизису в
момент прохождения ими щелей в синусоидах селезенки.
2) Талассемии. Возникают при снижении скорости синтеза а- или р-цепей. Это
приводит к развитию анемии, которая может иметь очень тяжелую форму.
Биосинтез тема и его регуляция
Гем - это простетическая группа гемоглобина, миоглобина, цитохрома, каталазы, пероксидазы. Синтезируется во всех клетках, но наиболее активно в печени и костном мозге.
Ключевой реакцией биосинтеза порфирина является образование аминолевулиновой кислоты, кофактор - пиридоксальфосфат. Активность фермента аминолевулинатсинтазы регулируется аллостерически и на уровне транскрипции гена фермента. Сам гем и гемоглобин являются аллостерическими ингибиторами и репрессорами синтеза этого фермента.

В результате трех последовательных реакций порфобилиноген преобразуется в протопорфирин 9, который в присутствии Feu и под действием фермента феррохелатаза переходит собственно в гем.
Анемии
Анемия - малокровие. Это состояние, при котором снижается содержание гемоглобина, а чаще и числа эритроцитов в единице объема крови, что приводит к снижению доставки кислорода к тканям (гипоксия). Считается, что у мужчин НЬ < 120, у женщин НЬ < 110 — гипоанемическое состояние.
Существует 2 группы анемий:
1 группа связана с нарушением гемоглобинообразования, продукции эритроцитов
и повышенным разрушением эритроцитов.
2 группа анемий возникает при кровопотерях.
Апластическая (гипопластическая) анемия возникает в результате угнетения костномозгового кроветворения (при действии физических, химических, лекарственных и других факторов на костный мозг)
Гемолитическая анемия - в результате укорочения жизни эритроцитов. Наиболее часто встречается наследственный сфероцитоз (дефект структуры мембран эритроцитов)
Мегалобластная (пернициозная) анемия, она же В и - дефицитная, бывшая злокачественная. Возникает в результате дефицита витамина В1г. . Причины дефицита: чаще атрофия слизистой оболочки желудка и нарушение всасывания витамина (связано с внутренним фактором Касла)
Железодефицитная - недостаточность поступления Fe с пищей, нарушение всасывания Fe после резекции желудка и кишечника, хронический энтерит. Чаще всего причиной является кровопотеря.
Пример: маточные кровотечения - при фибромиомах, ЖКТ кровотечения - при язвенной болезни, грыже пищеводного отверстия диафрагмы, геморрое.
Постгеморрагическая (острая) - возникает при острой массивной кровопотере (травмы, изъязвления кровеносных сосудов, например, маточные кровотечения, разрыв фаллопиевых труб, циррозы печени)
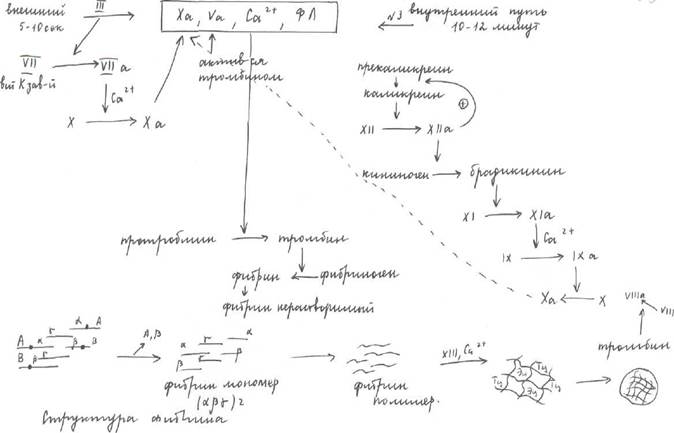
Гемостаз
План:
1. общая характеристика гемостаза
2. активация тромбокиназы. Роль факторов свертывания
3. коагуляция и ретракция. Строение фибриногена
4. фибринолиз. Противосвертывающая система
5. нарушение свертывания. Антикоагулянты
Гемостаз - остановка кровотечения после травматического повреждения кровеносных сосудов. Выделяют несколько фаз:
1. первичный гемостаз или тромбоцитарный: происходит сужение кровеносных
сосудов, агрегация тромбоцитов (скучивание тромбоцитов вокруг раны) и адгезия
('прилипание' тромбоцитов к краям раны). Заканчивается образованием белого
тромба (без эритроцитов)
2. гемокоагуляция, или собственно фаза свертывания, включает 3 этапа:
а) активация тромбокиназы (протромбокиназы) и превращение под ее
действием протромбина в тромбин,
б) коагуляция - превращение под действием тромбина фибриногена в фибрин,
в) ретракция - образование красного кровяного тромба путем превращения тромбина в нерастворимую форму.
3. фибринолиз - это растворение красного кровяного тромба, восстановление просвета кровеносных сосудов, восстановление циркуляции крови.
1 фаза: первичный гемостаз.
Кровотечение мелких сосудов останавливается за 1-3 минуты - время первичного гемостаза. Основная роль в этой фазе принадлежит тромбоцитам. Они обладают универсальным свойством, отличающим их от других клеток, способностью к агрегации. Адгезия тромбоцитов осуществляется благодаря фактору Виллебранда. Он способствует образованию мостика между эндотелиальными структурами и специфическими рецепторами на мембране тромбоцитов. В результате прилипший тромбоцит изменяет форму и выделяет АДФ, катехоламины^-агрегация усиливается. Из тромбоцитов выделяется серотонин (биогенный амин), в результате этого кровеносные сосуды еще более сужаются и просвет закупоривается тромбоцитами. Эта агрегация обратима. Необратимая осуществляется за счет производных арахидоновой кислоты, а именно под действием небольших количеств тромбина, который всегда есть в крови, в тромбоцитах активируется выработка вторичного посредника, который вызывает фосфорилирование специфических белков и выход ионов Саг* из депо. В результате активируется Са-зависимая фосфолипаза А 2, которая катализирует отщепление от фосфолипидов мембран тромбоцитов арахидоновой кислоты. Из нее под действием циклооксигеназы в результате последовательных реакций образуется тромбоксан А 2, который вызывает дальнейшее сужение сосудов и необратимую агрегацию тромбоцитов —> образуется белый тромб или тромбоцитарная пробка. Одновременно при разрушении мембраны тромбоцитов из нее выходят фосфолипиды - это тромбоцитарный фактор N3.
2 фаза: гемокоагуляция
Активация тромбокиназы. Тромбокиназа - это комплекс, включающий в себя Ха,
V фактор плазменный, ионы кальция и фосфолипиды.
Факторы обозначаются римскими цифрами. Существует 13 факторов + 2
дополнительных: прекаликреин (Флетчера), кининоген (Фитцжеральда).
Почти все синтезированы в виде проферментов, многие в печени, у многих
витамин К - зависимый синтез.
В тромбокиназе ферментативной активностью обладает X фактор —> активация
этого фермента сводится к активации X фактора.
тромбокиназа
|
Фибрина
|
В зависимости от фосфолипидов мембран различают внутренний и внешний пути активации тромбокиназы, а значит и свертывания.
Если ФЛ из мембран тромбоцитов № 3, то активация идет по внутреннему пути. Внутренний путь инициируется в области замедленного кровотока или аномальной стенки сосуда при отсутствии повреждения тканей. Если ФЛ из клеток поврежденных сосудов, то они будут называться фактором III – тканевой тромбопластин, активация будет идти по внешнему пути, он короче внутреннего. Внешний путь осуществляется VII фактором, Са2+ тканевым фактором III, неактивный, синтез в печени, витамин К — зависимый. В присутствии III тканевого фактора активируется, в присутствии ионов Са2+ он способен
активировать X фактор. Итог: внутренний и внешний пути одинаковы.
Внутренний путь (контактная фаза, так как фактор активируется при контакте с коллагеном сосудов, в его активации принимает участие каликреин, который образуется из прекаликреина).
На поверхности тромбоцитов есть рецептор к V фактору, в свою очередь этот рецептор + V фактор служат рецептором для Ха. Экспонируются ФЛ и способствуют связыванию Ca2+, который в свою очередь связывается с протромбином, а X фактор осуществляет его активацию путем частичного протеолиза.
Фибриноген -> фибрин
Фибриноген синтезируется в печени, состоит из 6 ППЦ (двух Аα, двух Вβ и двух γ - цепей). Тромбин гидролизует в этих цепях пептидные связи между глицином и аргинином с отщеплением фибринопептида А и В, которые обладают сосудосуживающим действием, в результате образуется фибрин мономер.
Под действием фибринопептида А и ионов кальция мономеры фибрина выстраиваются определенным образом и образуют фибрин полимер, он нестоек и может разрушаться => под действием фактора XIII фибринстабилизирующего и ионов Са2+ между волокнами фибрина образуются ковалентные сшивки и образуется трехмерная сеть с большим количеством ЭЦ и ТЦ. Образуется красный кровяной тромб, но ещ
|
|
|