 |
Задача 10 Рассчитайте изменение энтропии
|
|
|
|
Задача 1 Белок помещен в буф... Определить направление частиц белка.
Определяем рН раствора по формуле: рН = 14 – рОН = 14 + lg[OH-] = 14 + lg[5∙10-10] = 14 – 9,3 = 4,7.
В зависимости от того, находится ли это значение ниже или выше изоэлектрической точки данного белка, будет определяться направления движения частиц. Если значение ИЭТ выше рН, то белок катионный и движется к катоду, в противном случае – к аноду. Например, для глобулина (ИЭТ=5,4) частицы белка будут катоду, так как рН<ИЭТ.
Задача 2 Определить кол-во теплоты необходимого для нагревания 5 гр азота…
Объём газа не меняется, следовательно, процесс изохорный, поэтому всё количество теплоты будет идти на изменение внутренней энергии:
Q=i/2(m/M)RΔT
здесь i – число степеней свободы молекул газа. Принимая газ молекулярным (N2), учитываем, что он имеет 5 степеней свободы, поэтому i=5.
M – молярная масса (для молекулярного газа 28 г/моль или 0,028 кг/моль); m – масса газа (5 г), R=8,31 Дж/(моль∙К) – универсальная газовая постоянная; ΔT – изменение температуры (10 градусов).
Q = 5/2∙(5/28)∙8,31∙10 = 37,1 Дж
Ответ: Q=37,1 Дж.
Задача 3 Рассчитайте конц протонов слезной жидкости при ph = 7,4
Протон имеет заряд +1, поэтому концентрация протонов совпадает с концентрацией ионов водорода Н+. Так как рН=-lg[H+], то:
lg[H+]=-7,4
[H+]=10-7,4 моль/л = 0,4∙10-7 моль/л = 0,04 мкмоль/л.
Ответ: 0,04 мкмоль/л.
Задача 4 Определить стандартный тепловой эффект реакции… и -110,5 аДж/моль
Стандартный тепловой эффект реакции определяется как разность сумм стандартных теплот образования продуктов и исходных веществ с учётом стехиометрических коэффициентов:
ΔН0=2ΔН0(СО) + 2ΔН0(Н2) – ΔН0(СН4) – ΔН0(СО2) = -110,5∙2 + 0 – (-74,85 – 393,51) = 247,36 кДж/моль.
|
|
|
Ответ: 247,36 кДж\моль.
Задача 5 Вычислите ph раствора уксус кислоты
Уксусная кислота – слабая, константа диссоциации равна 1,8∙10-5, поэтому диссоциирует малая часть её молекул, следовательно, можно определить равновесную концентрацию молекул уксусной кислоты из формулы:
Ка=[H+]2/CCH3COOH,
Отсюда находим концентрацию ионов водорода:
[H+]=8,5∙10-4 моль/л
pH=-lg[H+]=-lg[8,5∙10-4] = 3,1.
Ответ: рН=3,1.
Задача 6 Определите тепловой эффект реакции…. 0 кДж/моль
Тепловой эффект определяется как разность сумм теплот сгорания исходных веществ и продуктов с учётом стехиометрических коэффициентов:
-873,79 – 1366,91 – (-2254,21 + 0) = 13,51 кДж/моль.
Ответ: 13,51 кДж/моль.
Задача 7. Смешали 2 раствора HCl: к 50 мл
Определим концентрацию кислоты хлористоводородной в полученном растворе.
Общий объём полученного раствора равен 50 + 300 = 350 мл
В первом растворе содержалось 0,05 л∙0,2моль/л = 0,01 моль кислоты.
Во втором растворе содержалось 0,3л∙0,02моль/л = 0,006 моль кислоты.
В полученной смеси будет содержаться 0,01 + 0,006 = 0,016 моль кислоты.
Концентрация будет равна 0,016 моль/0,35л = 0,046 моль.
Кислота хлористоводородная – сильная, в растворе полностью диссоциирует на ионы водорода и хлор-ионы, следовательно, концентрация ионов водорода будет равна концентрации кислоты и рН=-lg0,046 = 1,34.
Ответ: рН=1,34.
Задача 8 Рассчитайте теплоту образования N2O5
2 NO (г) + O2 (г) = 2NO2 (г)
4NO2 + O2 (г) = 2N2O5 (г)
N2 (г) + O2 (г) = 2NO (г)
Записываем уравнение образования N2O5 (г):
2 N2 + 5 O2 ------> 2 N2O5
Комбинируем имеющиеся уравнения. В основном уравнении слева 2 моля азота. Чтобы их получить берём третье уравнение, умноженное на 2. Теперь справа 2 моля NO, чтобы при сложении уравнений их компенсировать берём первое уравнение, умноженное на 2. Теперь NO компенсировались, но справа появились 4 моля NO2. Чтобы их компенсировать берем второе уравнение. Таким образом, складывая удвоенные первое и третье уравнения и одиночное второе получаем уравнение реакции образования N2O5 из N2 и О2. Но, теплота образования относится к 1 молю N2O5, а в уравнении реакции справа 2 моля. Значит, результат нужно поделить на 2. В итоге имеем:
|
|
|
Н (N2O5)=(2*H1+H2+2*H3)/2=H1+H2/2+H3=13,3 кДж/моль.
Задача 9 Найти поверхностное натяжение анилина
Поверхностное натяжение находим из формулы:

Здесь σ и σ0 – поверхностные натяжения искомое и для известной жидкости (вода); n и n0 – число капель анилина и воды; ρ и ρ0 – плотности анилина и воды.
Вычисляем: σ = 72,75∙10-3∙1,4∙103∙18/(42∙103) = 43,65∙10-3 Н/м.
Ответ: 43,65∙10-3 Н/м.
Задача 10 Рассчитайте изменение энтропии
Общее изменение энтропии складывается из трех составляющих: 1) нагревание твердой серы от 25 до 119 оС, 2) плавление, 3) нагревание жидкой серы от 119 до 200 оС.
 4.54 Дж/К.
4.54 Дж/К.
 2.58 Дж/К.
2.58 Дж/К.
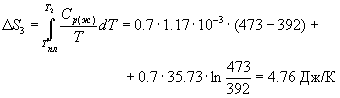
 S =
S =  S 1 +
S 1 +  S 2 +
S 2 +  S 3 = 11.88 Дж/К.
S 3 = 11.88 Дж/К.
Ответ. 11.88 Дж/К.
|
|
|


