 |
Задача 11 При определении альбумина по реакции бромкрезоловым зелёным
|
|
|
|
Общий объём полученного раствора:
50 + 13,2 = 63,2 мл
Вычислим концентрации компонентов после смешения растворов:
СМ (СН3СООН) = (Vисх. (СН3СООН) ⋅ СМ,исх.(СН3СООН)) / V = (50 ⋅ 1) /63,2 = 0,79 (моль/л),
СМ (NaOH) = (Vисх. (NaOH) ⋅ СМ,исх.(NaOH)) / V = (13,2 ⋅ 1) / 63,2 = 0,21 (моль/л).
При смешении растворов протекает реакция:
NaOH + CH3COOH → CH3COONa
Найдем концентрацию ацетата натрия (CH3COONa):
СМ (СН3СООNa) = 0,79 – 0,21 = 0,58 (моль/л).
В результате протекания реакции получили буферный раствор. Рассмотрим равновесия в буферном растворе:
| CH3COOH ↔ | CH3COO- | H+ |
| 0,58 – x | X | X |
| CH3COONa ↔ | CH3COO- | Na+ |
| 0,58 | 0,58 | 0,58 |
Константа диссоциации слабой кислоты рассчитывается по формуле:
K = [CH3COO-][H+]/[ CH3COOH]
Найдем х:
1,75 ⋅ 10–5 = х ⋅ (0,58 + х) / (0,58 – х)
Так как х << 0,58, то:
1,75 ⋅ 10–5 = х ⋅ 0,58 / 0,58 = х
Получаем:
[H+] = х = 1,74 ⋅ 10–5 (моль/л)
Получаем: рН = -lg1,74 ⋅ 10–5 = 4,76
Ответ: 4,76.
Задача 12 Вычислите кол-во теплоты при… при СУ
Уравнение окисления: С6H12O6 + 3O2 = 6CO2 + 6H2O + 280кДж
280 кДж – количество теплоты, выделяющееся при стандартных условиях.
Находим количество вещества глюкозы
n(C6H12O6) = m/M = 90г/180г/моль = 0,5 моль
Вычисляем количество теплоты:
при окислении 1 моль глюкозы выделяется – 280 кДж
при окислении 0,5 моль глюкозы выделяется - х кДж
х = 280∙0,5/1 = 140кДж
Ответ: 140 кДж.
Задача 13 Стандартная ЭДС (298 к) гальванического элемента
Определяем стандартный потенциал цинкового электрода по таблице: Е0(Zn2+/Zn) = -0,763 В, следовательно, стандартный электродный потенциал другого электрода, равен:
0,47 В – 0,763 В = -0,293 В, что соответствует Co2+/Co электроду.
Так как электродный потенциал кобальта меньше, чем цинка по абсолютной величине, то цинк является более активным металлом и будет вытеснять из раствора ионы кобальта, поэтому масса цинковой пластинки в ходе работы гальванического элемента уменьшится.
|
|
|
При растворении 10г хлорида аммония в 243 г воды температура понизилась на 2,8С. Определите тепловой эффект растворении соли, если удельная теплоемкость раствора составляет 4,18Дж/(г град).
Решение.
∆H р-ния = +- Q/n,
Cp=Q/m·∆Т
Где Q – количество теплоты, выделяющейся или поглощающейся при растворении соли;
n – количество растворяемого вещества.
Q = c × m(р-ра) × ∆t,
Где с – удельная теплоемкость, 4,18 Дж/г. град;
∆t – изменение температуры раствора при растворении соли.
n= m/M.
Так как температура раствора понизилась, ∆Н р-ния > 0;
∆H р-ния = + c × mр-ра × ∆t × M / mсоли =
= 4,18 Дж/г × град × 243 г × 2,8 град × 53,5 г/моль /10 г = 15216 Дж/моль = 15,216 кДж/моль.
Ответ: при растворении соли поглотилось 15,216 кДж/моль теплоты.
Задача 15 Напишите формулу мицеллы коллоидного раствора сульфата бария
Труднорастворимый барий сульфат образует кристаллический агрегат, состоящий из m молекул BaSO4. На поверхности агрегата адсорбируется n ионов Ва2+. С поверхностью ядра связано 2(n - x) хлорид ионов С1-. Остальные противоионы (2x) располагаются в диффузном слое:

16.Определите калорийность пищевого продукта массой 350 г, содержащего 50% воды, 30% белков,15% жиров и 5 % углеводов.
Решение:
m (белка)=350×0,30=105 г;
m (углевод.)=350×0,05=17,5 г;
m (жиров)=350×0,15=52,5 г.
Калорийность белков и углеводов составляет 17,1 кДж/моль калорийность жиров - 38 кДж/моль.
Калорийность пищевого продукта равна:
105×17,1 + 17,5×17,1 + 52,5×38,0 = 4089,75 кДж или
4089,75:4,18 = 978,4 ккал.
Ответ: калорийность 350 г пищевого продукта составляет 4089,75 кДж или 978,4 ккал.
Рассчитайте порог коагуляции и коагулирующую способность раствора сульфата натрия по отношению к гидрозолю иодида серебра, если коагуляцию 250мл золя вызывает сульфат натрия концентрации 0,15моль/л объемом 50мл.
|
|
|
Решение.
Порог коагуляции выражается величиной концентрации электролита коагулятора, которая вызывает коагуляцию лиозоля. Коагуляция золей – процесс, приводящий к агрегации частиц дисперсной фазы с последующим образованием осадка (коагеля). Обозначают порог коагуляции γ или СК. Размерность – ммоль/л или моль/л.
ᵧ = 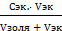 где,
где,
Сэк. – концентрация электролита коагулятора
Vэк. – объем электролита коагулятора
Vзоля - объем золя Коагулирующая способность электролита (коагулирующее действие)
Рк=  л/моль;
л/моль;
ᵧ =  =0,025 моль/л
=0,025 моль/л
Рк= 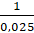 = 40л/моль
= 40л/моль
Задача 18 Вычислите энергию Гиббса….. для реакции гликолиза при СУ…
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G0(С6H12О6) = -917 кДж/моль; ∆G0(С3H6О3) = -539 кДж/моль. Используя первое следствие из закона Гесса, вычислим энергию Гиббса:
ΔG0 = 2×ΔG0 (C3H6O3) - ΔG0 (C6H12O6)
ΔG0 = 2(-539) – (-917) = -161 кДж/моль
Ответ: т.к. ΔG0 < 0, то реакция протекает самопроизвольно в прямом направлении.
|
|
|


