 |
Методические указания. По выполнению лабораторных работ. По дисциплине (модулю). «общая энергетика». Основной профессиональной образовательной программы
|
|
|
|
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное
образовательное учреждение высшего образования
«Тульский государственный университет»
ИВТС им. В. П. Грязева
Кафедра «Электроэнергетики»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по выполнению лабораторных работ
по дисциплине (модулю)
«Общая энергетика»
основной профессиональной образовательной программы
высшего образования – программы бакалавриата
по направлению подготовки (специальности)
13. 03. 02 Электроэнергетика и электротехника
с направленностью (профилем) (со специализацией)
Электроснабжение
Форма(ы) обучения: очная, заочная
Идентификационный номер образовательной программы:
130302-01-19
Тула 2020 год
Разработчик методических указаний
| Карницкий В. Ю., доцент, к. т. н. |
(ФИО, должность, ученая степень, ученое звание) (подпись)
Содержание
Лабораторная работа №1 «Основные определения термодинамики». 4
Лабораторная работа №2 «Изучение тепловых электрических станций». 13
Лабораторная работа №3 «Изучение теплоснабжения промышленных предприятий и бытовых потребителей». 31
Лабораторная работа №4 «Изучение атомных электрических станций». 46
Лабораторная работа №5 «Изучение гидравлических турбин». 53
Лабораторная работа №6 Изучение принципа действия солнечных электростанций 62
Лабораторная работа №7 Изучение принципа действия и конструкций геотермальных электростанций. 67
Лабораторная работа №8 Изучение конструкций и исследование параметров магнитогидродинамических электростанций. 71
Лабораторная работа №9 Изучение конструкции тепловой электрической станции ПГУ-450. 77
|
|
|
Лабораторная работа №10 Изучение гидроэнергетических установок. 99
Учебно-методическое обеспечение дисциплины.. 108
Лабораторная работа №1 «Основные определения термодинамики»
Цель работы: Изучить основные параметры и состояния пара.
1 Теоретические сведения
Основные определения
Из многочисленных задач, стоящих перед термодинамикой, одними из основных являются установление законов превращения энергии, главным образом теплоты, в работу и изучение процессов, посредством которых происходят эти превращения.
Процессы перехода теплоты в работу и обратные процессы - перехода работы в теплоту - осуществляются посредством рабочего тела, изменяющего свое физическое состояние при сообщении теплоты или при силовом на него воздействии.
В тепловых машинах рабочим телом является обычно газ или водяной пар.
Величины, характеризующие физическое состояние тела, называются термодинамическими параметрами состояния тела.
Для каждого состояния тела параметры принимают вполне определенные значения, не зависящие от массы тела и обусловливаемые лишь его внутренними молекулярными особенностями — скоростью молекул и их взаимным расположением.
За основные параметры принимаются: удельный объем, давление и температура, которые в совокупности определяют термодинамическое состояние тела. Из названных трех параметров лишь два являются независимыми.
Удельный объем представляет собой объем единицы веса, обычно 1 кг вещества.
Удельный объем, обозначаемый буквой v, определяется по формуле
 (1)
(1)
где V - полный объем тела;
G - вес.
Из формулы следует, что V=vG.
Величина, обратная удельному объему, т. е. вес единицы объема (1 м3), называется удельным весом и обозначается буквой g. Очевидно, что
|
|
|

G=gV (2)
Из формул (1) и (2) следует, что gv=1.
Параметром тела может являться его плотность - масса единицы объема, обозначаемая буквой ρ, определяемая по формуле

Это соотношение показывает, что удельный объем, удельный вес и плотность взаимно определяют друг друга и что поэтому каждый из них может служить одним из параметров тела.
Давление газа. Вторым параметром, определяющим состояние газа, является давление, оказываемое им на окружающую оболочку и являющееся результатом воздействия (ударов) на нее молекул газа, находящихся в хаотическом непрерывном движении.
Давление газа (при его равновесном состоянии), действующее по нормали к стенкам оболочки, равно и противоположно по направлению внешнему давлению.
Термодинамическим параметром, определяющим состояние газа, является не полное давление газа на оболочку, а удельное, т. е. его давление в килограммах, приходящееся на единицу поверхности: 1 м2 или 1 см2.
Давление газа, равное 1 кг/см2, называется технической атмосферой (ат).
1 ат = 1 кг/см2= 10 000 кг/м2.
В физике под одной атмосферой понимается давление воздуха на уровне моря на 45° географической широты, соответствующее давлению, производимому ртутным столбом высотой 760 мм при температуре, равной 0 °С. Это давление равно 1, 0333 кг/см2.
1 физ. ат = 1, 0333 техн. ат= 10333 кг/м2.
Сравнительно небольшие давления могут измеряться высотой столба жидкости.
Из определения физической атмосферы следует, что 1 физ. ат = 760 мм рт. ст. при 0 °С.
1 техн. ат=  = 735, 6 мм pт. cт. при 0 °С.
= 735, 6 мм pт. cт. при 0 °С.
Высота водяного столба при этих же условиях будет в 13, 595 раза больше высоты ртутного столба (ртуть в 13, 595 раза тяжелее воды).
1 ат = 1 кг/см2 = 736 мм. рт. ст. = 10 м вод. ст.
В абсолютной системе CGS (сантиметр, грамм-масса, секунда) за единицу силы принят дин, площади - квадратный сантиметр и давления - 1 дин/см2.
Давление, равное 106 дин/см2, называется «бар».
Бар является единицей, несколько большей, чем 1 техническая атмосфера.
1 ат = 1 кг/см2 = 0, 981 бар.
Для измерения давления применяются приборы — манометры, вакуумметры и барометры. Барометры применяются для измерения атмосферного давления, манометры — для измерения давления больше атмосферного, вакуумметры — для измерения давления меньше атмосферного. Устройство манометров и принципы их действия могут быть различными, но все они показывают избыток измеряемого давления (абсолютного ра) над атмосферным (барометрическим рб). Тогда
|
|
|
pа=pб + pм (3)
Таким образом, абсолютное давление газа равно избыточному давлению (манометрическому), сложенному с барометрическим давлением.
Вакуумметры показывают избыток атмосферного (барометрического) давления над измеряемым абсолютным давлением.
Поэтому
pа=pб - pв (3’)
т. е. в случае разрежения давление газа равно барометрическому давлению без вакуумметрического (pв)
Во все термодинамические формулы вводится абсолютное давление газа.
При измерении давления в атмосферах применяются следующие условные обозначения: ата — для абсолютного давления и ати — для избыточного.
Следовательно, если, например, манометр показывает 5 ати, то полное давление газа будет 6 ата.
Влияние на высоту столба ртути температуры. При возрастании температуры увеличиваются объем, а следовательно, и высота столба ртути, соответствующая данному давлению. Это явление приходится учитывать при вычислении по показанию барометра атмосферного давления.
При этих вычислениях высоту столба ртути барометра h приводят к высоте h0 при 0 °С по формуле
h0 = h (1 — 0, 000172t).
Тогда атмосферное давление (ат) при t °C будет равно:

Приведение высоты столба ртути барометра к 0 °С можно проводить графическим методом по диаграммам.
Температура. Температура является мерой нагретости тел. Тела имеют одинаковую температуру, если между ними не существует теплообмена, т. е. если они находятся между собой в тепловом равновесии, при котором будут равны средние значения кинетической энергии поступательного движения их молекул. Если же тела не находятся в тепловом равновесии и между ними имеется теплообмен, то тело, отдающее теплоту другому телу, обладает большей температурой, большей кинетической энергией молекул. Таким образом, температура определяет направление теплового потока. Разность температур тел определяет меру их отклонения от теплового равновесия. Различаются две температуры тел — эмпирическая и абсолютная.
|
|
|
Эмпирической температурой называется мера отклонения тела от состояния теплового равновесия с тающим льдом, находящимся под давлением в одну физическую атмосферу. За единицу температуры принят один градус, определяемый при условии, что температуре тающего под атмосферным давлении льда приписывается 0 °С, а температуре кипящей под атмосферным давлением воды — 100 °С.
Числовая величина температуры тела измеряется посредством термометров: ртутных, спиртовых и др. Для точных измерений температуры применяются газовые термометры. Принцип действия этой группы термометров основан на расширении тел при нагревании. В технике пользуются также термометрами, действие которых основано не на свойстве расширения тел при нагревании, а на других их физических свойствах. Например, применяются термоэлементы, термометры сопротивления и пр.
Абсолютная температура. Равенство при тепловом равновесии тел, их температур и средних кинетических энергий поступательного движения их молекул показывает, что между температурой тела и средней кинетической энергией его молекул имеется прямая пропорциональность. Температура, пропорциональная средней кинетической энергии поступательного движения молекул тела, называется абсолютной. Абсолютная температура должна принимать значение, равное нулю при состоянии тела, при котором прекратилось бы тепловое движение его молекул. Эта предельная минимальная температура называется абсолютным нулем и является началом для отсчета температур.
Различие между абсолютной температурой и эмпирической состоит прежде всего в том, что первая отсчитывается от предельно низкой температуры — от абсолютного нуля и является всегда положительной величиной, тогда как эмпирическая температура отсчитывается от некоторой произвольно выбранной начальной температуры — температуры таяния льда под атмосферным давлением — и поэтому может быть как положительной, так и отрицательной величиной. Введение абсолютной шкалы устраняет условность при оценке значения температуры и начала ее отсчета, неизбежные при измерении температуры по шкалам, построенным с использованием физических свойств тех или иных веществ.
Абсолютная температура тела может быть измерена посредством газового термометра. На основании закона Гей-Люссака можно показать, что постоянная точка идеального газового термометра, являющаяся началом отсчета температур, лежит на 273, 16 °С ниже нуля стоградусной шкалы. Шкала водородного термометра дает незначительное отклонение от шкалы идеального газа. Между абсолютной температурой тела, обозначаемой через Т К или Табс, и температурой эмпирической, измеряемой по стоградусной шкале, обозначаемой через t °С, имеется зависимость:
|
|
|
Т = t + 273, 16,
или приближенно
Т = t + 273.
Из этого соотношения следует, что 0 К = — 273 °С и 0 °С = 273 К.
Второй закон термодинамики позволяет обосновать сущность абсолютной температуры и дает научное основание для построения абсолютной шкалы температур. На основании этого закона вводится так называемая термодинамическая температура, которая тождественна с абсолютной температурой
Пар. Паром называется реальный газ со сравнительно высокой критической температурой, а также близкий к состоянию насыщения.
За реальными газами с низкими критическими температурами сохраняется обычно название газов вплоть до состояния насыщения.
Парообразование. Парообразованием называется процесс перехода жидкости в пар.
Испарение. Испарением называется парообразование, происходящее только с поверхности жидкости и при любой температуре. Интенсивность испарения зависит от природы жидкости и температуры.
При испарении понижается температура жидкости. Это явление обуславливается тем, что при испарении жидкости из нее вылетают молекулы, обладающие сравнительно большими скоростями, вследствие чего и уменьшается средняя скорость движения оставшихся в ней молекул. Испарение жидкости может быть полным, если над жидкостью находится неограниченное пространство.
Кипение. При сообщении жидкости теплоты увеличиваются ее температура и интенсивность испарения. При некоторой вполне определенной температуре, зависящей от природы жидкости и давления, 'под которым она находится, наступает парообразование во всей ее массе. Пузырьки пара начинают ори этом образовываться у стенок сосуда и внутри жидкости. Это явление называется кипением жидкости.
Конденсация. Процесс превращения пара в жидкость, осуществляющийся при отнятии от него тепла и являющийся процессом, обратным парообразованию, называется конденсацией. Этот процесс, так же как и парообразование, происходит 'При постоянной температуре, если будет постоянным давление. Жидкость, образующаяся при конденсации пара в паросиловых установках, называется конденсатом.
Возгонка, или сублимация. Возгонкой, или сублимацией, называется процесс перехода вещества из твердого состояния непосредственно в пар.
Десублимация. Процесс, обратный процессу сублимации, т. е. процесс перехода пара непосредственно в твердое состояние, называется десублимацией.
Насыщенный пар. При испарении жидкости в ограниченное пространство одновременно происходит и обратное ему явление, т. е. процесс сжижения, вызываемый тем, что некоторые из молекул, движущихся в паровом пространстве по всем направлениям, ударяясь о поверхность жидкости и попадая при этом в сферу влияния ее молекул, возвращаются обратно в жидкость. По мере испарения и заполнения паром пространства над жидкостью уменьшается интенсивность испарения и увеличивается интенсивность обратного ему процесса возврата молекул из парового пространства в жидкость. В некоторый момент, когда скорость конденсации станет равной скорости испарения, в системе наступает динамическое равновесие. При этом состоянии число молекул, вылетающих из жидкости, будет равно числу молекул, возвращающихся в нее обратно из парового пространства.
Следовательно, в паровом пространстве при этом равновесном состоянии будет находиться возможное максимальное число молекул. Пар при этом состоянии имеет максимальную плотность и называется насыщенным. Следовательно, под насыщенным понимается пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется. Насыщенный пар имеет температуру, являющуюся функцией его давления, равного давлению среды, в которой происходит процесс кипения. При увеличении объема насыщенного пара при постоянной температуре происходит переход некоторого количества жидкости в пар, при уменьшении же объема при постоянной температуре — переход пара в жидкость, но как в первом, так и во втором случаях давление пара остается постоянным.
Сухой насыщенный пар получается при испарении всей жидкости. Объем и температура сухого пара являются функциями давления. Вследствие этого состояние сухого пара определяется одним параметром, например давлением или температурой.
Влажный насыщенный пар, получающийся при неполном испарении жидкости, является смесью пара с мельчайшими капельками жидкости, распространенными равномерно во всей его массе и находящимися в нем во взвешенном состоянии. Весовая доля пара во влажном паре называется степенью сухости и обозначается через х, а весовая доля жидкости обозначается через у и называется степенью влажности. Очевидно, у =1-х.
Для сухого пара х=1, а для воды х=0. В процессе парообразования степень сухости пара постепенно увеличивается от нуля до единицы.
Таким образом, состояние влажного пара определяется двумя параметрами, например давлением (или температурой) и степенью сухости.
Перегретый пар. При сообщении сухому пару теплоты при постоянном давлении температура его будет увеличиваться. Пар, получаемый в этом процессе, называется перегретым.
Таким образом, под перегретым понимается пар, температура которого выше температуры насыщенного пара того же давления. В отличие от насыщенного пара, температура которого является функцией лишь одного давления, перегретый пар имеет температуру, зависящую от давления и объема. Разность между температурой перегретого пара и температурой насыщенного пара того же давления называется степенью перегрева.
Так как удельный объем перегретого пара больше удельного объема насыщенного пара того же давления, то в единице объема перегретого пара содержится меньшее число молекул, чем в единице объема насыщенного пара. Вследствие этого перегретый пар является не насыщенным и обладает меньшей плотностью, чем соответствующий насыщенный пар.
Перегретые пары по своим физическим свойствам приближаются к газам и тем в большей мере, чем выше степень их перегрева. Состояние перегретого пара, так же как и газа, определяется двумя любыми независимыми параметрами (например, давлением и температурой).
На рисунке 1 представлены кривые, которые устанавливают для некоторых веществ зависимость между давлением и температурой кипения.
Приведенная диаграмма, построенная по экспериментальным данным, показывает, что температуры кипения различных веществ при одном и том же давлении весьма значительно отличаются друг от друга.

Рисунок 1- Кривые зависимости между давлением и температурой кипения
Энтальпия. В термодинамике во многих случаях, особенно когда тело определяется независимыми параметрами р и Т, применяется не внутренняя энергия, а другая функция состояния тела, называемая энтальпией или теплосодержанием. Энтальпия, обозначаемая через i, имеет выражение:
i= u+Apv
Таким образом, энтальпия равна внутренней энергии тела, сложенной с величиной рv, представляющей собой работу, которую необходимо затратить, чтобы ввести рассматриваемое тело с объемом v в окружающую его внешнюю среду, имеющую давление р и находящуюся с телом в равновесном состоянии.
Эта работа, отдаваемая среде, является ее потенциальной энергией и называется потенциальной энергией давления. Следовательно, энтальпия является суммой внутренней энергии тела и потенциальной энергии давления среды. Иначе, энтальпия есть энергия тела и внешней среды, т. е. энергия расширенной системы – тела и окружающей среды.
Энропия. Соотношение:
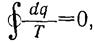
полученное для обратимых циклов, устанавливает весьма важные положения термодинамики. Действительно, поскольку интеграл по  замкнутому контуру от выражения
замкнутому контуру от выражения  - равен нулю, то (как известно из математики) подынтегральное выражение представляет собой полный дифференциал некоторой функции, в данном случае — функции состояния тела.
- равен нулю, то (как известно из математики) подынтегральное выражение представляет собой полный дифференциал некоторой функции, в данном случае — функции состояния тела.
Эта функция состояния называется энтропией, обозначается для 1 кг газа через s и измеряется в ккал/кг∙ град. Для произвольного количества газа энтропия, обозначаемая через S, будет равна S = Gs, где G — вес газа, кг.
Тогда

Следовательно, энтропия представляет собой некоторую однозначную функцию состояния тела, принимающую для каждого его состояния определенное значение. Это свойство энтропии аналитически может быть выражено соотношениями

где р, v, v, T и р, Т — независимые параметры, определяющие состояние тела.
Как видим, энтропия принадлежит к той же группе термодинамических величин, к которой относятся внутренняя энергия, энтальпия и др. Тогда энтропия, так же как и все термодинамические величины этой группы, будет обладать определенными общими для этой группы величин свойствами, состоящими в том, что изменения этих величин в процессе не зависят от его характера и полностью определяются крайними состояниями тела в процессе и что, наконец, изменения этих величин в циклах равны нулю.
Контрольные вопросы
1. Что такое удельный объем, удельный вес, плотность.
2. Чему равна температура в К при 0 º С.
3. Дайте определения энтропии, энтальпии.
4. Дайте определения или опишите процесс парообразования, испарения, кипения, конденсации, возгонки, десублимации, насыщенного пара, сухого насыщенного пара, влажного насыщенного пара, перегретого пара.
2 Порядок выполнения работы
1. Ознакомиться с теоретической частью лабораторной работы.
2. Определить давление при заданной температуре кипения для различных веществ, согласно таблицы 1, и рисунку 1. (Необходимо определить давление в мм. рт. ст., избыточное давление в ати, и давление в кг/см2, если 1 физ. ат =1, 0333 кг/см2=760 мм. рт. ст. )
3 Составить отчет по выполненной работе.
Содержание отчета
Отчет должен содержать краткое изложение теоретических сведений изученных при выполнении работы.
В отчете должно быть определенно давление при заданной температуре кипения для различных веществ.
Таблица 1 - Данные для определения давления
| № варианта | tкип º С | Вещество | № варианта | Tкип º С | Вещество |
| -90 | СО2 | Н2О | |||
| -80 | СО2 | Н2О | |||
| -70 | СО2 | Н2О | |||
| -50 | СО2 | Н2О | |||
| -30 | СО2 | Н2О | |||
| -10 | СО2 | Нg | |||
| СО2 | Нg | ||||
| СО2 | Нg | ||||
| СО2 | Нg | ||||
| СО2 | Нg | ||||
| Н2О | Нg | ||||
| Н2О | Нg | ||||
| Н2О | Нg | ||||
| Н2О | Нg | ||||
| Н2О | Нg |
|
|
|


