 |
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
|
|
|
|
Коэффициент k называется константой скорости реакции, не зависит от концентрации реагирующих веществ, зависит от природы реагирующих веществ, температуры и наличия в системе катализатора.
Численно константа скорости соответствует скорости при единичных концентрациях (удельная скорость). Размерность константы скорости зависит от молекулярности реакции.
Закон действующих масс применим только к элементарным реакциям. Сложные реакции протекают через ряд промежуточных стадий и стехиометрическое уравнение не соответствует молекулярности реакции, а отражает суммарный процесс.
ПРИМЕР. 2Н2О2 = 2Н2О + О2, по закону действующих масс u = k× C2 (Н2О2), что не
соответствует экспериментальным данным, согласно которым u = k× C (Н2О2
Дело в том, что процесс идет в две стадии: 1) Н2О2 = Н2О + О и 2) О + О = О2
Первая стадия, как более медленная, определяет скорость суммарного
процесса.
Зависимость скорости реакции от концентрации реагирующих веществ, установленная опытным путем, называется кинетическим уравнением. Сумма показателей при концентрациях в кинетическом уравнении называется порядком реакции. Так, реакция разложения пероксида водорода есть реакция первого порядка. В отличие от молекулярности порядок реакции может быть и дробным, и нулевым.
В гетерогенных системах скорость реакции относится к единице поверхности и не зависит от концентрации твердой фазы.
ПРИМЕРЫ. 2Mg + O2 = 2MgO, u = k× C (O2) – реакция первого порядка
СаСО3 (к) = СаО (т) + СО2, u = k = const – рекция нулевого порядка
Зависимость скорости реакции от температуры. Энергия активации.
Согласно правилу Вант-Гоффа, сформулированного на основе опытных данных, для большинства химических реакций скорость возрастает примерно в 2¸4 раза при повышении температуры накаждые 10 градусов.
|
|
|
u t = u0 × a Dt/10 или kt = k × a Dt/10, где а = 2¸4 – температурный коэффициент реакции.
Какова причина столь значительного влияния температуры на скорость химических реакций?
На первый взгляд это можно было бы объяснить тем, что при повышении температуры скорость движения частиц возрастает, увеличивается число их соударений, в том числе и эффективных соударений, приводящих к взаимодействию. Однако, как показывают расчеты, при повышении температуры от 0° до 100 °С скорость движения молекул увеличивается примерно в полтора раза, тогда как скорость реакции – в 1000 раз (если принять а = 2).
Главная причина заключается в том, что при повышении температуры резко возрастает число активных молекул, обладающих достаточной энергией для перегруппировки связей в момент столкновения. Только при столкновении активных молекул происходит перераспределение электронной плотности и образование новых молекул, т.е. столкновения являются эффективными.
Этот процесс требует затраты времени и энергии. Мгновенных процессов в природе вообще не существует. Следовательно, любая система в ходе химических превращений переходит из начального состояния в конечное через какое-то промежуточное (переходное) состояние:
[ начальное ] ¾¾¾¾¾® [ переходное ] ¾¾¾¾¾® [ конечное ]
ослабление перераспределение образование новых
химических связей элктронной плотности химических связей
Например, для реакции H2 + J2 = 2HJ, путь реакции можно представить следующим образом:
H J H………J H ¾ J
½ + ½ ¾¾¾¾® M M ¾¾¾¾® +
H J H………J H ¾ J
активированный комплекс
Переходное состояние системы отвечает образованию так называемого активированного комплекса. В активированном комплексе как бы объединены “полуразрушенные “ молекулы H2, J2 и “полуобразовавшиеся” молекулы HJ. Активированный комплекс существует очень короткое время (~ 10-13 с). Его распад приводит к образованию молекул HJ, либо молекул H2, J2. Образование активированного комплекса требует определенной затраты энергии, но затраты гораздо меньшей, чем в случае полного разрыва химических связей в исходных молекулах и образования отдельных атомов (см. рис. 12). Затем при распаде активированного комплекса энергия выделяется. Если выделяется больше, чем было затрачено на образование активированного комплекса, то реакция экзотермическая (DН < 0), в противном случае – эндотермическая (DН > 0).
|
|
|
Рис.1. Энергетическая схема хода реакции H2 + J2 = 2HJ
Энергия, необходимая для перехода веществ в состояние активированного комплекса, называется энергией активации Еа (или энтальпией активации DНа). Энергия активации – это своеобразный энергетический барьер реакции, который должны преодолеть молекулы, чтобы произошло взаимодействие между ними. Молекулы, обладающие избыточным количеством энергии (по сравнению со средней величиной при данной температуре), достаточным для преодоления энергетического барьера реакции, называются активными.
Чем больше активных молекул в реакционной системе, тем выше скорость реакции. В любой газовой системе вследствие хаотического движения молекул энергия распределяется неравномерно. Кривая распределения Максвелла-Больцмана, приведенная на рис.2, позволяет определить количество активных молекул в системе при данной температуре (заштрихованная область).
Рис.2. Распределение молекул в системе по энергиям при разных температурах
Из рисунка видно, что число молекул с энергией, превышающей Еа, резко возрастает с повышением температуры. Обычно рост температуры в арифметической прогрессии приводит к увеличению числа активных молекул, а, следовательно, и скорости реакции в геометрической прогрессии.
Зависимость скорости реакции от температуры и энергии активации определяется выражением
константы скорости реакции:
k = A × e -Ea/RT (уравнение Аррениуса).
Сомножитель А учитывает также вероятность надлежащей ориентации молекул при столкновении:
|
|
|
A = Z × e DSa/RT, где DSа – энтропия активации,
e DSa/RT – стерический фактор,
Z – множитель, отражающий общее число столкновений в единицу времени.
Влияние катализатора на скорость химической реакции.
Одним из распространенных в химической практике методов ускорения химических реакций является катализ. Катализ – это ускорение химической реакции веществом катализатором, активно участвующим в промежуточных стадиях реакции, но выходящим из этой реакции химически неизменным. Благодаря этому катализатор многократно повторяет реакцию с новыми порциями веществ, поэтому небольшие количества катализатора оказывают большое воздействие. Катализатор изменяет путь реакции за счет образования промежуточных соединений между катализатором и исходными веществами и снижения энергии активации каждой отдельной стадии, что приводит к увеличению скорости всей реакции в целом.
ПРИМЕР
Рассмотрим реакцию А + В = АВ, которая имеет высокую энергию активации Еа и протекает поэтому с очень малой скоростью. При введении в систему третьего вещества К (катализатор), которое легко вступает во взаимодействие с А, образуется соединение АК:
A + K ¾® A……K ¾® AK, для этой стадии Еа¢<< Еа.
активированный комплекс
Соединение АК далее легко взаимодействует с веществом В, образуя вещества АВ и К:
В + АК ¾® В…….АК ¾® АВ + К, для этой стадии Еа²<< Еа.
активированный комплекс
Суммарная реакция будет: А + В = АВ, т.е. катализатор остался без изменения, энергия активации реакции снижается на величину DЕ, скорость реакции возрастает, хотя процесс протекает в две стадии.
Рис.3. Энергетическая схема хода реакции в присутствии катализатора
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
В случае гомогенного катализа реагирующие вещества и катализатор представляют гомогенную систему (реагирующие вещества газообразные и катализатор – газ).
|
|
|
ПРИМЕР. Реакция получения серного ангидрида 2SO2 + O2 = 2SO3, катализатор – NO.
1 стадия O2 + 2NO = 2 NO2
2 стадия SO2 + NO2 = SO3 + NO
В случае гетерогенного катализа реагирующие вещества и катализатор представляют разные фазы, реакция идет на поверхности катализатора.
ПРИМЕР.
Реакция получения серного ангидрида 2SO2 + O2 = 2SO3, катализатор – V2O5 или Pt.
Механизмы химических реакций.
1. Молекулярный Н2 + I2 = 2 HI E активации = 150¸450 кДж/моль
2. Ионный Ag+ + Cl- = AgCl 0 ¸ 80
3. Радикальный (цепные реакции) Н2 + С12 = 2НС1 0 ¸ 40
Радикалы – валентно ненасыщенные частицы: атомы, молекулы, осколки молекул NO, H, O, CH3 и др. Основной признак свободного радикала – наличие холостого электрона, который и обуславливает высокую реакционную способность частицы. Появление в смеси одного радикала приводит к возникновению цепи последовательных превращений и реакция быстро охватывает весь реакционный объем. Таким образом протекают в частности реакции горения.
ПРИМЕР.
Смесь водорода и хлора в темноте может храниться очень долго, скорость реакции мала.
При освещении вспышкой магния происходит взрыв реакционной смеси. Идет цепная реакция: Сl2 +hn® Cl(×) + H2 = HCl + H(×) + Cl2 = HCl + Cl(×) и т.д.
Cl(×) + H2 = …….
Cl(×), H(×) – радикалы, атомы с одним непарным электроном.
Реакция прекращается на стенке сосуда или на частице большей массы, которая забирает избыточную энергию и электрон. Такова роль триэтилсвинца при горении бензина в двигателях внутреннего сгорания.
Химическое равновесие.
Химические реакции бывают обратимые и необратимые. Подавляющее большинство химических реакций – обратимые, т.е. начиная протекать в одном направлении, затем идут в обоих направлениях (за счет взаимодействия как исходных веществ, так и продуктов реакции). Обратимые реакции не протекают до конца.
Совершенно необратимых реакций очень мало, например:
2H2O2 = 2H2O + O2 – разложение пероксида водорода,
2KClO3 = 2KCl + 3O2 – разложение бертолетовой соли,
Pb(N3)2 = Pb + 3N2 - разложение азида свинца.
Вопросы химического равновесия могут быть рассмотрены только для обратимых реакций. Рассмотрим обратимую реакцию в общем виде aA + bB = dD + eE.
Скорость прямой реакции uпрямой = k1CAaCBb. По мере расходования исходных веществ скорость
прямой реакции уменьшается.
Скорость обратной реакции uобратной = k2CDd CEe. По мере накопления продуктов реакции скорость
возрастает.
Через некоторое время t скорости прямой и обратной реакций станут равны, что соответствует состоянию химического равновесия.
Рис.4. Изменение скорости в ходе реакции
Истинное равновесие является динамическим, подвижным. Это означает, что при наступлении равновесия как прямая, так и обратная реакция продолжают идти. Но наблюдатель, находящийся вне системы, увидит, что реакция как бы остановилась, поскольку концентрации всех веществ перестанут меняться. Сколько, например, вещества А расходуется в ходе прямой реакции, столько же его и образуется в ходе обратной. Концентрации веществ в условиях равновесия (моль/л) называют равновесными концентрациями и обозначают в квадратных скобках.
|
|
|
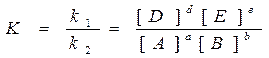 |
В условиях равновесия uпрямой = uобратной, из чего следует, что отношение констант скоростей прямой и обратной реакций есть величина постоянная:
Величину К – называют константой равновесия. Этой величине не приписывают никакой размерности, но концентрации обязательно молярные (моль/л). Она характеризует глубину протекания реакции. Зависит от природы реагирующих веществ и температуры. Она связана с изменением стандартной энергии Гиббса уравнением: DG0 = -RT lnK. Большим отрицательным значениям DG0<< 0 отвечают большие значения К>>1, т.е. прямая реакция протекает в значительной степени и в равновесной смеси преобладают продукты реакции. При больших положительных значениях DG0>>0 константа равновесия К<<1, что означает, что прямая реакция практически не протекает.
В случае гетерогенных реакций концентрация твердой фазы в выражение константы равновесия не входит.
Для выражения состояния равновесия в реакциях с участием газообразных веществ часто вместо концентраций используют равновесные парциальные давления реагентов.
 |
ПРИМЕРЫ. 1) N2 + 3H2 = 2NH3
2) CaCO3(т) = CaO(т) + CO2, K = [CO2] или K = p (CO2}
Смещение равновесия.
Поскольку химическое равновесие подвижное, то при внешних воздействиях (изменении С, р, Т) оно нарушается, концентрация всех веществ в системе будет изменяться до тех пор, пока не установится новое положение равновесия. Если внешнее воздействие убрать, то система возвращается в исходное равновесное состояние.
Принцип Ле-Шателье. Если изменить одно из условий, при которых система находится в равновесии (С, р, Т), то равновесие смещается в сторону протекания той реакции, которая ослабляет воздействие.
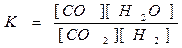 |
ПРИМЕРЫ. CO2 + H2 = CO + H2O(г)
CO2 + H2 = CO + H2O(г) Увеличим концентрацию СО2. Это вызовет уменьшение
концентрации Н2 и увеличение концентраций СО и Н2О до тех пор,
С(СО2) ¾¾® пока их новые соотношения не будут снова равны К.
N2 + 3H2 = 2NH3 Увеличим давление. Система стремится ослабить внешнее воздействие, т.е.
Р ¾¾¾® уменьшить число молей в системе. Начнет протекать прямая реакция до тех
пор, пока не установится новое положение равновесия.
N2O4 = 2NO2, DH > 0 Увеличим температуру. Поскольку процесс эндотермический, т.е. в ходе
Т ¾¾® реакции тепло поглощается, то увеличение температуры будет
способствовать протеканию прямой реакции.
Влияние катализатора. Катализатор ускоряет в одинаковой степени и прямую и обратную реакции, поэтому на полноту протекания процесса (на выход реакции) он не влияет, но сокращает время установления равновесия.
|
|
|


