 |
Концентрации растворенного вещества и не зависят от природы вещества.
|
|
|
|
DТкип = Е × сm
DTзам = К × сm, где сm – моляльная концентрация растворенного вещества,
[моль/кГ растворителя],
DТкип = Tкип (раствора) - Ткип (растворителя)
DТзам = Tзам (растворителя) – Тзам (раствора)
E, K – эбулиоскопическая и криоскопическая константы,
характеризуют свойства растворителя, [ град × кГ/моль],
их значения для некоторых растворителей приведены в
справочнике:
Растворитель К Е
Вода 1,86 0,52
Бензол 5,1 2,64
Таким образом, суть законов Рауля сводятся к следующему утверждению:
понижение упругости пара растворителя, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном количестве данного растворителя и не зависят от природы растворенного вещества.
Законы Рауля в химии используют для определения молекулярных масс вновь синтезированных веществ.
Растворы электролитов. Теория электролитической диссоциации.
Электролитами называют вещества, растворы которых за счет электролитической диссоциации (ионизации) проводят электрический ток. Ионизации могут подвергаться либо все молекулы растворенного вещества, либо часть молекул.
Степень ионизации.
Способность электролита к ионизации выражают величиной, называемой степенью ионизации (a)-это доля молекул (молей) вещества, распавшихся на ионы.
a = Срасп / Сисх, выражается в долях или %.
Если Срасп @ Сисх, то a®1, что характерно для сильных электролитов.
Если Срасп << Сисх, то a®0, что характерно для слабых электролитов
Степень ионизации зависит от многих факторов:
1. От природы химических связей растворяемого вещества. Чем полярнее связь, тем больше a.
В кристалле NaCl – ионный тип связей, в молекулах НС1 – сильно полярные связи. При
|
|
|
растворении этих веществ в воде происходит практически полная ионизация молекул, значение a
близко к 1 (или 100%).Упрощенно реакцию ионизации можно записывать так:
NaCl Þ Na+ + Cl-,
HCl Þ H+ + Cl-
В молекулах уксусной кислоты СН3СООН связь –О-Н малополярная, в водном растворе только
малая часть молекул ионизована, a<< 1. Образующиеся ионы и нераспавшиеся молекулы
находятся в состоянии химического равновесия (Û):
СН3СООН Û СН3СОО- + Н+
(НАс) (Ас-)
2. От природы растворителя. Чем полярнее связи в молекулах растворителя, тем больше a.
НС1 диссоциирует при растворении в воде и не диссоциирует при растворении в бензоле.
3. От концентрации электролита. Для сильных электролитов зависимость сложная. Для слабых –
чем меньше концентрация растворенного вещества, тем больше степень ионизации (смотри закон
разведения Оствальда).
Изотонический коэффициент.
Ионизация приводит к увеличению общего числа частиц по сравнению с числом растворенных молекул, поэтому измеренные опытным путем величины DТкип, DТзам, понижение упругости пара Dр оказываются больше, чем рассчитанные по законам Рауля.
Так, если взять раствор NaCl с концентрацией 0,1 (моль/ кГ воды), то по уравнению Рауля
DTзам = К × сm = 1,86 × 0,1 = 0,186 градуса, а согласно экспериментальным данным DТзам = 0,336 градуса, т.е. число частиц возросло.
Для того, чтобы можно было применять законы Рауля к растворам электролитов, Вант-Гофф ввел поправочный коэффициент i и назвал его изотоническим (уподобляющим). Изотонический коэффициент всегда больше единицы, т.к. показывает во сколько раз увеличивается вследствие ионизации число частиц в растворе по сравнению с числом молекул, введенных изначально в раствор.
Общее число частиц в растворе (нераспавшиеся молекулы + ионы)
i = ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾ ³ 1,
|
|
|
Число растворенных молекул
i = 1 для растворов неэлектролитов
NaCl Þ Na+ + Cl-, i ® 2
AlCl3 Þ Al3+ + 3Cl-, i ® 4
НАс Û Н+ + Ас-, 1 < i << 2
 |
Изотонический коэффициент позволяет использовать законы Рауля для расчета свойств растворов электролитов: DTзам = i Kcm, DTкип = i Ecm,
Зависимость, связывающая a и i.
Пусть, N - число молекул растворенного вещества,
k - число ионов, образующихся при распаде каждой молекулы,
aN – число распавшихся молекул,
kaN – число ионов,
(N - aN) - число нераспавшихся молекул.
 |
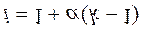 |
 |
Теория слабых электролитов (a<< 1)
Слабые электролиты: 1) растворы всех органических кислот, например, СН3СООН – уксусная, НСООН –муравьиная и др.; 2) растворы органических оснований (аминов), например, СН3NH2×Н2О; 3) раствор аммиака в воде NH3×Н2О; 4) растворы некоторых неорганических кислот H2S, H2CO3, HCN и др.
Связи в молекулах ковалентные, малополярные, ионизация незначительна, поэтому процесс ионизации всегда сопровождается процессом молизации, т.е. процесс ионизации есть процесс обратимый и равновесный. Применим закон действующих масс и принцип Ле-Шателье.
Рассмотрим обратимую реакцию НА Û Н+ + А-. Запишем константу равновесия
 |
Константа равновесия реакции ионизации называется константой ионизации. Константы ионизации слабых кислот называют также константами кислотности (Кк), их значения для стандартных условий можно найти в справочнике. Чем меньше значение константы ионизации, тем слабее электролит. Электролиты, имеющие константы ионизации меньше 10-4, относят к слабым электролитам, например, для уксусной кислоты Кк = 1,74.10-5, для синильной кислоты HCN
Кк = 4,79.10-10 (очень слабая кислота).
Зависимоть К, a, С для бинарного электролита (закон разведения Оствальда).
Рассмотрим процесс ионизации слабого бинарного электролита (молекула распадается на два иона) в общем виде:
АВ Û А+ + В-
С - -
aС aС aС
 |
С-aС aС aС
Для очень слабых электролитов a®0 и тогда К @ a2С –закон разведения Оствальда для бинарного электролита. Разбавление раствора слабого электролита сопровождается увеличением степени ионизации.
|
|
|
Смещение равновесия в растворе слабого электролита.
Рассмотрим процесс диссоциации уксусной кислоты СН3СООН, формулу которой часто записывают упрощенно как НАс:
НАс Û Н+ + Ас- (*)
Если к этому раствору добавить сильную кислоту, например, НС1, которая при диссоциации дает дополнительно ионы Н+, то по принципу Ле-Шателье рановесие процесса (*) смещается в обратную сторону, т.е. степень ионизации уксусной кислоты уменьшается (a¯).
Если в раствор уксусной кислоты ввести соль этой же кислоты – СН3СООNa (упрощенно NaAc), которая при диссоциации дает дополнительно ионы Ас-, то это также способствует смещению равновесия процесса (*) в обратную сторону и степень ионизации уксусной кислоты уменьшается.
Таким образом, если в раствор слабого электролита вводятся дополнительно одноименные ионы, то процесс ионизации слабого электролита «подавляется» и степень его ионизации уменьшается.
Диссоциация многоосновных кислот и многокислотных оснований.
Многоосновной кислотой называют кислоту, один моль которой может взаимодействовать с двумя и более ионами ОН-, например, Н2СО3, Н3РО4. Н3РО4 + 3ОН- = РО43- + 3Н2О
Процесс ионизации таких кислот протекает ступенчато:
ì Н3РО4 = Н+ + Н2РО4- К1 = 7.10-3
3 кислоты í Н2РО4- = Н+ + НРО42- К2 = 6.10-8 ½ сила кислот
î НРО42- = Н+ + РО43- К3 = 5.10-13 ½
Суммарная константа ионизации равна произведению ступенчатых констант: K=K1×K2×K3.
Таким образом, в растворе имеем смесь трех кислот. Наиболее прочный ион, наиболее слабая кислота – НРО42-. По принципу Ле-Шателье более сильная кислота подавляет диссоциацию более слабых кислот, поэтому многоосновные кислоты диссоциируют преимущественно по первой ступени. Поэтому в растворе ортофосфорной кислоты находятся в основном ионы Н2РО4- и ионы водорода (гидроксония Н3О+). Для приближенных расчетов концентраций водородных ионов и процессов, происходящих в кислых средах, вполне достаточно пользоваться только первой константой ионизации, т.е. считать электролит бинарным. В кислых растворах возможно образование кислых солей, например, Th(HPO4)2¯. В щелочных растворах преобладают ионы PO43- и образуются средние соли, например, Са3(РО4)2¯.
|
|
|
Аналогично может быть рассмотрена ионизация многокислотных оснований.
Это рассмотрение приводится редко, т.к. большинство многокислотных оснований малорастворимы в воде.
ПРИМЕР. Pb(OH)2 = Pb(OH)+ + OH-, K1 ~ 10-3
Pb(OH)+ = Pb2+ + OH-, K2 ~ 10-8
Вследствие ступенчатой диссоциации многокислотых оснований возможно образование основных солей, например, Sn(OH)Cl¯.
Теория сильных электролитов
Сильные электролиты в водных растворах диссоциируют нацело. К ним относятся:
1) растворы солей;
2) растворы кислот HNO3, HCl, HBr, HI, HClO4, H2SO4(по первой ступени ионизации);
3) растворы гидроксидов щелочных металлов (щелочи) и гидроксидов кальция, стронция, бария.
Особенности растворов сильных электролитов.
Свойства, которые проявляют растворы сильных электролитов, не соответствуют истинной концентрации ионов в растворе. Изотонический коэффициент, рассчитанный из опытных данных, не является целым числом (2,3,4 и т.д.), степень ионизации, определенная экспериментально, оказывается меньше 100% (хотя нераспавшихся молекул нет)
ПРИМЕР. Рассмотрим соль NaCl. В кристалле соли находятся только ионы, которые под
воздействием молекул воды переходят в раствор (ион-дипольное взаимодействие):
Nan+ Cln- + n (x + y) H2O ¾¾® nNa+ × x H2O + nCl- × yH2O
кристалл гидратированные ионы
Процесс диссоциации необратим. Молекул нет ни в кристаллах, ни в растворе. Значит,
теоретически i = 2, a =1.
Экспериментально установлено, что раствор соли с моляльной концентрацией сm =
0,1(моль/кГ воды) имеет температуру замерзания минус 0,336 0С. Таким образом,
DТзам = 0,336 градусов. По закону Рауля DТзам = i Kcm. Тогда, i = 0,336/(1,86×0,1) = 1,8.
a = (i – 1)/(k – 1) = (1,8-1)/(2-1) = 0,8 (или 80%) – кажущаяся степень ионизации.
Дело в том, что в растворах электролитов количество заряженных частиц (ионов) намного больше, чем в растворах неэлектролитов. Каждый ион в растворе не свободен, он электростатически
взаимодействует с полем ионов другого знака. То есть
каждый гидратированный ион окружен противоионной
атмосферой. Сила взаимодействия поля ионов на данный
ион будет зависеть от концентрации всех ионов Сi, от их
зарядов Zi и радиусов ri.
Каждый отдельно взятый ион будет тормозиться полем ионов, отсюда уменьшение электропроводности растворов (следовательно, уменьшение a, значение которой определяют экпериментально по электропроводности), уменьшение скоростей химических реакций, изменение температур фазовых переходов. То есть получается, что концентрация отдельно взятого иона, проявляющаяся в физическом или химическом эксперименте, меньше, чем истинная.
|
|
|
Чтобы отразить специфику растворов сильных электролитов, вводят понятие активность ионов (аi)– это некая условная (эффективная) концентрация ионов, в соответствии с которой они действуют в реальных растворах, ai < Сi (истинная концентрация), а = f×С, где f – коэффициент активности. Он учитывает электростатическое взаимодействие между данным ионом и полем других ионов, f £ 1. Он может быть вычислен, как некоторая зависимость от ионной силы раствора, заряда и радиуса данного иона f = F(m, z, r)
 |
Ионная сила раствора m, учитывающая воздействие поля всех ионов на данный ион, вычисляется по формуле:
 |
Так как в данной формуле нет радиуса иона, то она справедлива для разбавленных растворов.
Значения коэффициентов активности можно найти в справочнике.
ПРИМЕР. Рассчитаем активную концентрацию ионов соли в 0,01 М растворе А1С13.
А1С13 Þ А13+ + 3С1-
0,01 моль/л 0,01 моль/л 0,03моль/л
m = 0,5 (0,01×32 + 0,03×12) = 0,06
Из справочника: f (Al3+) = 0,21, f (Cl-) = 0,84, тогда а (А13+) = 0,01×0,21 = 0,0021,
а(С1-) = 0,03×0,84 = 0,025
Ион алюминия более активно тормозится полем ионов, чем однозарядный ион хлора.
Труднорастворимые электролиты. Гетерогенное равновесие.
Произведение растворимости
Любая соль может растворяться в воде до тех пор, пока не установится равновесие между осадком и раствором, пока не получится насыщенный раствор.
АnBm Û nA+m + mB-n
Если растворимость соли очень велика, то это равновесие устанавливается
только при очень большой концентрации соли (вполне определенной в
зависимости от температуры, смотри справочник).
Если растворимость соли мала, то равновесие устанавливается практически
всегда и растворимость может быть вычислена по значению константы
равновесия.
Поскольку система гетерогенная, то выражение константы равновесия имеет вид, приведенный ниже, и назвается произведением растворимости:
K = [A+m]n× [B-n]m = ПР или более строго ПР = аn (A+m)×am(B-n) – произведение активностей.
Правило ПР. В насышенном растворе труднорастворимого электролита произведние
|
|
|


