 |
Активный центр фермента. Механизм действия ферментов
|
|
|
|
Рис. 5
Без специфического действи ферментов был бы невозможен упорядо-
ченный обмен веществ в клетках, а, следовательно, и сама жизнь.
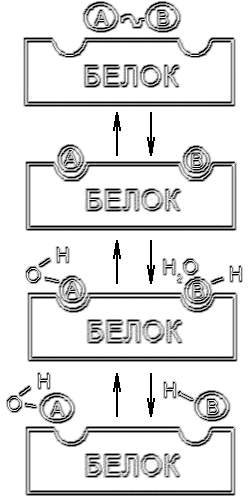
Активный центр фермента
Изучение специфичности белка привело ученых исследова-
телей к выводу, что молекула субстрата реагирует не со всей
молекулой фермента, размеры которой во много раз превы-
шают размеры молекулы субстрата, а с ее отдельным участ-
ком, получившим название активного центра. Активный
центр - участок белковой молекулы, который обеспечивает
соединение фермента с субстратом и дает возможность для
дальнейших превращений субстрата. Активный центр должен представлять со-
бой определенную структуру, приспособленную для тесного сближения и взаи-
модействия с молекулой субстрата; активный центр должен обладать выражен-
ным сродством к соответствующему субстрату. Первоначально думалось, что мо-
лекулы ферментов имеют много активных центров, однако, позднее стало ясно,
что каждая молекула фермента содержит один или два активных центра. Поверх-
ность любого белка состоит из множества разнородных химических групп, при-
надлежащих боковым цепям аминокислот. Каждая из них может играть ту или
иную роль в работе фермента, влияя на конформацию молекулы и на взаимодей-
ствие с субстратом в силу своих особенных химических свойств или же просто в
силу своего присутстви (стерический эффект). В составе активного центра вы-
деляют различные по своим функциям участки. Одни из них обеспечивают сце-
пление фермента с субстратом, прочный контакт с ним (якорные или контакт-
ные участки), другие выполняют собственно каталитическую функцию, активи-
|
|
|
руют субстрат (каталитические участки). Такое условное разделение помогает
более точно представить механизм каталитической реакции. Значение функци-
ональных групп белка дл структуры и каталитического действия ферментов
очень многообразно. Атомы кислорода, серы, азота участвуют в образовании
водородных связей и комплексов с металлами. Кислые и основные группы в
зависимости от состояния и диссоциации функционируют в активных центрах
ферментов в качестве кислотных и основных, нуклео- и электрофильных ката-
лизаторов. Эти группы могут действовать непосредственно на субстрат ли из-
менять своим электростатическим воздействием реакционноспособность со-
седних групп молекул фермента. Аминные, гидроксильные и некоторые другие
группы во многих ферментативных реакциях выполняют функции промежуточ-
ных акцепторови переносчиков протонов, ацильных, фосфорильных гликозиль-
ных, амидиновых, альдегидных, метильных и других остатков. Группы SH, SS
участвуют в обратимых окислительных превращениях и в других реакциях об-
мена. Значение влияни функциональных групп на активность фермента играет
роль при классификации. Активность фермента зависит и от его конфигурации.
Эти представления о влиянии функциональных групп на строение и активность
молекулы фермента опровергают теорию Фишера, который считал, что молекула
субстрата точно подходит к молекуле фермента, как ключ к замку. В простых фер-
ментах активный центр образуется определенной группировкой аминокислот-
ных остатков в спиральной цепи белковой молекулы. В сложных ферментах, сос-
тоящих из белка и небелкового компонента, в состав которого входят, например,
нуклеотиды, атомы металлов и др., активный центр образуется главным образом
небелковым компонентом и некоторыми прилегающими к нему аминокислот-
ными остатками.
Механизм действия ферментов
|
|
|
Вопрос о механизме действия ферментов издавна являлся предметом для
оживленных дискуссий ученых. Была выдвинуто огромное количество различ-
ных теорий, основная идея которых все же заключалась в том, что соединение
фермента с молекулой вещества вызывает активацию молекул субстрата вслед-
ствие поляризации связи, смещения электронов, деформации связей, вовлека-
емых в реакции. В ферментативных реакциях активация субстрата происходит
с образованием фермент-субстратного комплекса. Образование и превращения
фермент-субстратных комплексов можно разделить на три этапа:
1. Присоединение молекулы фермента к молекуле субстрата
2. Превращение первичного промежуточного соединения в один или нес-
колько последовательных активированных комплексов
3. Отделение конечных продуктов реакции от фермента
S+E  SE
SE  ES*
ES*  E+P
E+P
(1) (2) (3)
S - исходный субстрат
E - энзим (фермент)
SE - первичный фермент-субстратный комплекс
ES* - нестабильный переходный активированный комплекс
P - продукт реакции
Первая стадия реакции протекает наиболее быстро. Первичный комплекс
образуется за счет слабых типов связей и при достаточно низкой энергии акти-
вации. Однако только пространственного связывани фермента с субстратной
молекулой недостаточно дл прохождения ферментативного катализа. Во вто
рой стадии реакции преобразования связаны с разрывом и замыканием кова-
лентных связей. Предполагается, что в фермент-субстратном комплексе части-
цы субстрата подвергаютс деформации, что приводит к изменению прочности
отдельных химических связей. В результате этого снижаетс уровень энергети-
ческого барьера и возникают быстро протекающие реакции, катализируемые
ферментом. Образование фермент-субстратных комплексов возможно при учас-
тии различных типов связей: ковалентных, координационных, ионных, водород-
ных, а также при участии электростатических сил притяжения между отдельны-
ми полярными группами.
|
|
|


