 |
Реакция с феррицианидом калия
|
|
|
|
Для идентификации аскорбиновой кислоты применяют красную кровяную соль, которая в щелочной среде восстанавливается аскорбиновой кислотой до желтой кровяной соли. После подкисления реакционной смеси и добавления раствора хлорида железа (III) образуется синий осадок берлинской лазури:

| |
| Синий осадок берлинской лазури |
Реакция с солями серебра
Аскорбиновая кислота восстанавливает даже такие слабые окислители, как йод, соли ртути и серебра:

Химические свойства жирорастворимых витаминов и их анализ
Витамины группы А
Витамины группы А легко окисляются кислородом воздуха с потерей витаминной активности. Они легко изомеризуются по связям 11:

| |
| 11- транс -ретиналь | 11- цис -ретиналь |
Тем не менее, в клетке молекулы ретинола и ретиноевой кислоты отличаются тем, что все двойные связи находятся в транс- конфигурации. Наиболее легко цис - транс -изомеризации (фотоизомеризации) подвергается ретиналь.
Галохромная реакция
Для идентификации витамина А используется его реакция с хлоридом сурьмы, в ходе которой образуется комплексное соединение с сопряженной системой двойных связей имеющее синюю окраску.
Галохромная реакция имеет место также при действии на сопряженные системы связей концентрированной серной кислоты.
Витамины группы D
Эргокальциферол (D2) и холекальциферол (D3) так же, как и витамин А, дают окрашивание с хлоридом сурьмы. Поскольку сопряженная система двойных связей кальциферолов короче, чем у витамина А, окрашивание развивается не синее, как в случае витамина А, а оранжево-розовое. Кальциферолы в связи с наличием в их молекулах двойных связей легко реагируют с бромом, кислородом воздуха и другими окислителями.
|
|
|
Витамины группы Е
Реакция с азотной кислотой
Для идентификации a-токоферола и его ацетата используется реакция с азотной кислотой с нагреванием до температуры 80°С. При этом в таких жестких условиях токоферолаацетат гидролизуется, и далее образующийся a-токоферол окисляется азотной кислотой с образованием орто -токоферилхинона, окрашенного в красно-оранжевый цвет:

Витамины группы К
Реакция восстановления
Идентификация витаминов К1, К2 и К3 основана на реакции их восстановления, например цинком в кислой среде. При этом характерная для этих витаминов желтая окраска исчезает вследствие образования бесцветного 1,4-дигидрокси-2-метилнафталина. Эти соединения легко конденсируются с ароматическими аминами в кислой среде с образованием более глубоко окрашенных соединений. Например, при взаимодействии менадиона с пара -аминофенолом в кислой среде появляется синее окрашивание, характерное для индофенолов.
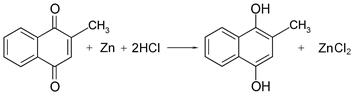
| |
| Менадион | 1,4-Дигидрокси-2-метилнафталин |

| ||
| Менадион (желтого цвета) | пара -Аминофенол (бесцветный) | Индофенольное соединение синего цвета |
Контрольные вопросы
1. Понятие о витаминах, провитаминах, антивитаминах.
2. Классификация и номенклатура витаминов.
3. Жирорастворимые витамины. Общая характеристика.
4. Химическое строение, свойства, биологическая роль жирорастворимых витаминов: А, D, Е, К.
5. Водорастворимые витамины. Общая характеристика.
6. Химическое строение, биологическая роль, коферментные формы витаминов: B1, B2, B3, B5, B6, Bс, B12, Н, Р, С.
7. Принципы методов качественного определения витаминов.
Литература
1. Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993
2. Горячковский А.М., Справочное пособие по клинической биохимии, ОКФА, Одесса, 1994
|
|
|
3. Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998
4. Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000.
5. Северин Е.С., Алейникова Т.Л., Осипов Е.В., Силаева С.А.,Биологическая химия,«Медицинское информационное агентство», М., 2008.
6. Чиркин А.А., Практикум по биохимии, «Новое знание», Минск, 2002.
7. Кухта В.К., Морозкина Т.С., Олецкий Э.И., Таганович А.Д., Биологическая химия, «Бином», М., 2008.
8. Березов Т.Т., Коровкин Б.Ф., Биологическая химия, «Медицина», М., 2007.
9. Белясова, Н.А. Биохимия и молекулярная биология, «Книжный Дом», Минск, 2004.
10. Чиркин А.А., Данченко Е.О., Биохимия, «Медицинская литература», М., 2010.
Дополнительная литература
1. Nelson D.L., Cox M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004.
2. Metzler D., Biochemistry, (The chemical reactions in living cells), Elsevier, Academic Press, V. 1-2, 2003-2004.
3. Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006.
ХОД РАБОТЫ
| Цель работы: | Изучение химических свойств витаминов и методов их идентификации в растворе. |
| Задание I | Проведение качественных реакций на водорастворимые витамины. |
Витамин В1
Реакция с диазореактивом. витамин В1 в щелочной среде с диазореактивом образует сложное комплексное соединение оранжевого или красного цвета.
Ход работы: В пробирку вносят 5 капель 1% раствора сульфаниловой кислоты и 5 капель 5% раствора NaNO2 (в пробирке образуется диазореактив). К диазореактиву добавляют 5 капель раствора тиамина и затем по стенке, наклонив пробирку, осторожно добавляют 5 капель 10% раствора NaНCO3. На границе раздела двух жидкостей появляется кольцо оранжевого цвета.
Витамин В2
Реакция восстановления рибофлавина. Реакция на витамин В2 основана на его способности легко восстанавливаться; при этом раствор с витамином, обладающий желтой окраской, приобретает сначала розовый цвет промежуточных соединений, а затем обесцвечивается, в связи с тем, что восстановленная форма витамина В2 бесцветна.
Ход работы: В пробирку вносят 10 капель раствора витамина В2, добавляют 5 капель концентрированной НСl и опускают кусочек металлического цинка. Начинается выделение пузырьков водорода, жидкость постепенно розовеет, затем обесцвечивается.
Витамин РР
Качественная реакция с ацетатом меди. Витамин РР при нагревании с раствором ацетата меди образует синий осадок медной соли никотиновой кислоты.
|
|
|
Ход работы: В пробирку вносят 7 капель раствора витамина РР, затем приливают 10 капель 5% раствора (СН3СОО)2Сu. Выдерживают в водяной бане 2 – 3 минуты. Наблюдают выпадение осадка медной соли никотиновой кислоты.
Витамин В6
Реакция с хлоридом железа (III). Витамин В6 при взаимодействии с раствором хлорного железа образует комплексную соль типа фенолята железа красного цвета.
Ход работы: На часовое стекло нанести 3 капли 5% раствора FeCl3 и 3 капли раствора витамина В6. Смесь перемешивают. Наблюдают за развитием красного окрашивания.
Витамин Р
Качественная реакция с хлоридом железа (III). Хлорид железа образует с рутином комплексное соединение, окрашенное в изумрудно- зеленый цвет.
Ход работы: В пробирку вносят 5 капель водного раствора рутина и добавляют 3 капли 5% раствора FeCl3.
Качественная реакция с концентрированной серной кислотой. Концентрированная серная кислота образует с рутином соли, растворы которых характеризуются ярко-желтой окраской.
Ход работы: В пробирку вносят 5 капель водного раствора рутина и прибавляют осторожно по стенке 3 капли концентрированной H2SO4. На границе двух жидкостей наблюдают окрашенное в желтый цвет кольцо.
Витамин С
Качественная реакция с феррицианидом калия (К3[Fe(CN)6]). Реакция основана на способности витамина С легко вступать в окислительно-восстановительные реакции.
Ход работы: К 5 каплям раствора витамина С прибавляют по несколько капель 10 %-ного раствора NaOH и 10 % раствора К3[Fe(CN)6]. Перемешивают, затем добавляют 3 капли 10 %-ного раствора НСl (для подкисления) и 2 капли 10 % раствора FeCl3. Появляется сине-зеленое окрашивание, и постепенно образуется синий осадок берлинской лазури – Fe4[Fe(CN)6] 3.
Качественная реакция с раствором Люголя. Реакция основана на способности витамина С восстанавливать молекулярный йод из раствора Люголя с образованием йодистоводородной кислоты.
Ход работы: В пробирку добавить 5 капель раствора витамина С и 2 капли раствора Люголя. Наблюдается обесцвечивание раствора.
|
|
|
| Задание II | Проведение качественных реакций на жирорастворимые витамины |
Витамин А
Реакция с серной кислотой. Серная кислота, обладая водоотнимающим свойством, образует с витамином А окрашенный комплекс синего цвета, переходящий затем в фиолетовый и далее в бурый цвет.
Ход работы: На часовое стекло наносят 3 капли раствора рыбьего жира, затем 5 капель хлороформа и 1 каплю концентрированной H2SO4. Наблюдают соответствующее окрашивание.
Реакция с сульфатом железа (II). В пробирку вносят 3-4 капли раствора рыбьего жира в хлороформе, 5-10 капель ледяной уксусной кислоты, насыщенной сульфатом железа (II) и 2-3 капли концентрированной серной кислоты. В присутствии витамина А появляется голубое окрашивание, постепенно переходящее в розово-красное. Каротины дают при этой реакции зеленое окрашивание.
Витамин D
Бромхлороформная проба.
Ход работы: На часовое стекло (под часовое стекло следует предварительно подложить лист белой бумаги) наносят 3 капли рыбьего жира и прибавляют 5 капель раствора брома в хлороформе. В присутствии витамина D смесь окрашивается в зеленовато-голубой цвет.
Реакция с анилиновым реактивом.
Ход работы: В пробирку вносят 3 капли рыбьего жира, затем 5 капель хлороформа и 3 капли анилинового реактива. Осторожно нагревают пробирку до появления красного окрашивания. Пробирку оставляют в штативе остывать. Через несколько минут эмульсия разделяется. Нижний слой, при наличии витамина в исходном материале, окрашен в интенсивно красный цвет.
Витамин Е
Реакция с азотной кислотой. В присутствии азотной кислоты токоферол окисляется через промежуточное образование токоферолхинона до орто-, или парохинона, имеющего красное окрашивание.
Ход работы: В пробирку вносят 5 капель 0,1% спиртового раствора витамина Е и несколько крупинок сахарозы, затем по стенке пробирки приливают 1 мл концентрированной HNO3. Пробирку интенсивно перемешивают и наблюдают окрашивание.
Реакция с хлоридом железа (III). Спиртовой раствор α–токоферола окисляется хлоридом железа (ІІІ) в токоферилхинон и раствор окрашивается в красный цвет.
Ход работы: В пробирку вносят 5 капель 0,1% спиртового раствора витамина Е и добавляют 0,5 мл 1% раствора FeCl3. Встряхнув содержимое пробирки, наблюдают появление красного окрашивания.
Витамин К
Реакция с цистеином.
Ход работы: На часовое стекло наносят 5 капель 0,05% спиртового раствора витамина К, 5 капель 0,025% спиртового раствора цистеина и 1 каплю 10% раствора гидроксида натрия. Наблюдают лимонно-желтое окрашивание.
|
|
|
Реакция с анилином.
Ход работы: В пробирку вносят 5 капель 0,05 % спиртового раствора витамина К, добавляют 2 капли анилина. Осторожно встряхивают содержимое пробирки и наблюдают красное окрашивание, что обусловлено образованием 1-метил-2-фениламинонафтохинона.
| Задание III | Методы количественного определения витаминов |
|
|
|


