 |
1. 3. Описание реакций фазовых равновесий
|
|
|
|
1. 3. Описание реакций фазовых равновесий
1. 3. 1. Моновариантные реакции
Анализ различных типов диаграмм состояния двойных систем позволяет сделать некоторые обобщения относительно изображения фазовых равновесий и записи фазового превращения в виде реакции. В реакции любого фазового превращения указываются исходная фаза или фазы, вступающие во взаимодействие, и новые фазы, образовавшиеся после окончания фазового превращения; температурный интервал превращения и изменения химического состава фаз в процессе превращения. Равновесие фаз для данного сплава при изменении температуры изображается совокупностью двух точек, а и в, лежащих на линиях диаграммы, ограничивающих данную двухфазную область и соединенных изотермой ав (см. рис. 1. 1).
Согласно правилу фаз Гиббса, такое фазовое превращение является моновариантным (С = 1), т. е. можно изменять или температуру, или концентрацию, не нарушая равновесия системы. Реакцию фазового равновесия записывают в следующем виде:
t1 – t2
Ф1 ↔ Ф2,
где Ф1 – исходная фаза; Ф2 - вновь образовавшаяся фаза; t1 и t2 – температуры начала и конца превращения.
Исходной фазой может быть жидкость (жидкий металл или жидкий раствор), новой фазой – жидкий раствор другого состава или твердая фаза (компонент, твердый раствор, промежуточная фаза).
Рассмотрим существующие варианты двухфазных равновесий и их реакции. Реакция равновесия обозначается двойной стрелкой, а направление фазового превращения – одинарной.
1) расслоение жидкого раствора: Ж’ ↔ Ж’’, где Ж’ и Ж’’ – жидкие растворы разного химического состава;
2) кристаллизация твердой фазы из жидкой: Ж ↔ Ф, где Ф – компонент, твердый раствор или химическое соединение (промежуточная фаза);
|
|
|
3) полиморфное превращение: Фa ↔ Фb;
4) частичный распад твердого раствора или промежуточной фазы:
Ф1 ↔ Ф2, где Ф1 – это граничный твердый раствор или промежуточная фаза переменного состава; Ф2 – компонент, твердый раствор, химическое соединение (промежуточная фаза);
5) расслоение твердого раствора: Ф’ ↔ Ф’’, где Ф’, Ф’’ – твердые растворы различного химического состава одного типа кристаллической структуры;
6) превращение “беспорядок в порядок” и наоборот: Ф ↔ Ф’, где Ф и Ф’ – фазы неупорядоченная и упорядоченная.
1. 3. 2. Нонвариантные реакции
Равновесие трех фаз в двухкомпонентной системе изображается совокупностью трех точек, лежащих на изотерме, где две точки крайние, а третья располагается между ними (рис. 1. 2).

Рис. 1. 2. Схема трехфазных равновесий
В соответствии с правилом Гиббса такое фазовое превращение является нонвариантным (С = 0), т. е. происходит при постоянной температуре и неизменном химическом составе всех равновесных фаз.
Все трехфазные равновесия можно свести к двум типам: эвтектическому и перитектическому.

Здесь C1, C2и C3 – химический состав соответствующих фаз.
В первом случае при охлаждении из одной фазы (жидкого или твердого раствора) образуются две новые фазы, которыми могут быть жидкий раствор, компонент, твердый раствор или соединение (промежуточная фаза).
Во втором – из двух взаимодействующих фаз образуется одна фаза. В качестве исходных фаз выступают жидкие растворы, компонент, твердые растворы или химические соединения, а новой фазы – твердые растворы или химические соединения.
Рассмотрим фазовые превращения с образованием двух фаз из одной (тип I) с участием как жидкой, так и двух твердых фаз.
1) эвтектическое превращение:
Ж ↔ Ф1 + Ф2 (рис. 1. 3 по линии abc).

|
|
|
Рис. 1. 3. Диаграмма с эвтектическим нонвариантным равновесием
Из жидкого раствора при охлаждении кристаллизуются одновременно две твердые фазы постоянного состава (Ф1 и Ф2 – компоненты, твердые растворы, промежуточные фазы). Физико-химическая смесь двух фаз, образовавшихся при кристаллизации из жидкого раствора, называется эвтектикой . Эвтектическое превращение встречается во многих системах, например, Pb–Bi, Pb–Sb; Al–Si, Al–Sn; Cd–Zn, Sb–Ge и др. Сплавы с эвтектикой обладают хорошей жидкотекучестью и применяются чаще всего в качестве литейных сплавов;
2)монотектическое превращение:
Ж’ ↔ Ж’’ + Ф,
где Ж’, Ж’’ – жидкие растворы различного химического состава, Ф – компонент, твердый раствор или промежуточная фаза (рис. 1. 4, по линии ab). Монотектическое превращение наблюдается в системах Se с Cd, Pb, Ga, Bi; Cu с V, Nb и др. и используется при разработке технологических процессов обогащения и извлечения цветных металлов из промежуточных продуктов обжига полиметаллических руд;
3) метатектическое превращение:
Ф1↔ Ж + Ф2,
где Ф1 – граничный твердый раствор или промежуточная фаза, Ж – жидкий раствор, Ф2 – твердый раствор или промежуточная фаза (рис. 1. 5, по линии kmn). В качестве примера можно привести системы: Ag–Li, Cu–Sn, Fe–Zn, Mn c Cu, In и др.;
4) эвтектоидное превращение, или полный распад твердого раствора:
Ф1 ↔ Ф2 + Ф3,
где Ф1 – граничный твердый раствор или промежуточная фаза, Ф2, Ф3 – компоненты, твердые растворы, промежуточные фазы (рис. 1. 4, по линии kem). Тонкая физико-химическая смесь двух фаз, образовавшаяся при распаде твердого раствора, называется эвтектоидом . Эвтектоидное превращение встречается во многих системах и используется для упрочнения сплава, особенно на основе Fe и Ti;

Рис. 1. 4. Монотектическое, вырожденное перитектическое (tпр > tпл. В) и эвтектоидное преврашения: а – диаграмма состояния; б – кривая охлаждения и реакции превращения

Рис. 1. 5. Метатектическое и эвтектическое превращения: а – диаграмма равновесия, б – кривая охлаждения и реакции превращений
5) монотектоидное превращение:
Ф1’ ↔ Ф1’’ + Ф2,
где Ф1’, Ф1’’– твердые растворы, отличающиеся химическим составом, Ф2 – твердый раствор или промежуточная фаза (рис. 1. 6 по линии amb).
|
|
|

Рис. 1. 6. Монотектоидное и полиморфное превращения:
а – диаграмма равновесия; б – кривая охлаждения и реакции превращений
Монотектоидное превращение связано с расслоением твердого раствора и встречается в системах Al–Zn, а также Zr c Hf, U, Th; Sc–Ti, Fe–Ni; Zr c Th, U и др.
К фазовым превращениям II типа относятся превращения с образованием новой фазы из двух взаимодействующих:
1) синтектическое превращение:
Ж’ + Ж’’ ↔ Ф,
где Ж’, Ж’’ – жидкие растворы разного химического состава, Ф – химическое соединение или промежуточная фаза переменного состава (рис. 1. 7, по линии asb). Встречается в системах In–Rb, Ca–K, Fe–O и др. Расслоение жидкости также используется в технологических процессах извлечения цветных металлов;
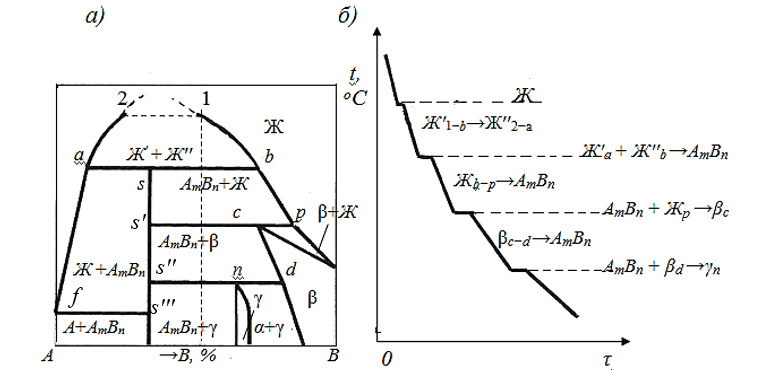
Рис. 1. 7. Синтектическое, перитектическое, перитектоидное и вырожденное (tпер. < tпл. А) эвтектическое превращения: а – диаграмма состояния; б – кривая охлаждения и реакции превращений
2) перитектическое превращение:
Ж + Ф1 ↔ Ф2
(рис. 1. 7, по линии s′ cp). При взаимодействии жидкого раствора с твердой фазой (компонентом, твердым раствором или промежуточной фазой) образуется новая фаза (твердый раствор, химическое соединение или промежуточная фаза). Встречается во многих системах, например, Pt c W, Ag, Ru; Ti c W, Os; Au–Bi и др.
3) перитектоидное превращение:
Ф1 + Ф2 ↔ Ф3
(рис. 1. 7, по линии s′ ′ nd). В качестве фаз Ф1 и Ф2 могут быть компоненты, твердые растворы или промежуточные фазы, Ф3 – химическое соединение или промежуточная фаза. Встречается во многих системах: Mn–Au, Mn–C; Zr–Аl, Co–V и др.
Когда система рассматривается при низких давлениях или высоких температурах (более 2000оС), а также системы типа металл – газ, то возможны равновесия с участием газовой фазы G. Приведем наиболее вероятные реакции нонвариантных равновесий при указанных условиях:
| I тип | G ↔ Ж1 + Ж2; G ↔ Ф1 + Ф2; Ж ↔ G + Ф; | G ↔ Ж + Ф; Ж1 ↔ G + Ж2; Ф1 ↔ G + Ф2; |
| II тип | G + Ж1 ↔ Ж2; G + Ж ↔ Ф; | G + Ф ↔ Ж; G + Ф1 ↔ Ф2. |
|
|
|
Кривые охлаждения и реакции с различными типами фазовых превращений представлены на диаграммах состояния (рис. 1. 4-1. 7).
В некоторых системах происходит реакция оплавления Ф → Ж (ретроградный солидус) при охлаждении некоторой части твердой фазы в интервале концентрации с–a, где Ф – твердый раствор, Ж – жидкий раствор (рис. 1. 5 по линии kmn).
В ряде случаев на диаграммах состояния одна фаза (средняя точка трехфазного равновесия) имеет близкий химический состав с другой (одной из крайних точек на горизонтали). Такое фазовое превращение называется вырожденным, и тип равновесия определяется в результате сравнения температуры фазового превращения с температурой плавления компонентов (рис. 1. 4 – по линии cd, рис. 1. 7 – по линии f-s′ ′ ′ ).
В некоторых системах на базе химического соединения АхВу (устойчивого или неустойчивого) могут образовываться фазы переменного состава с изменяющимся соотношением компонентов А и В. Такие фазы обозначаются обычно буквами греческого алфавита по аналогии с твердыми растворами (например, γ на рис. 1. 7) или формулой химического соединения в скобках – (АхВу).
|
|
|


