 |
Глава 10. Сцепленное наследование
|
|
|
|
Комплексная цель:
Дать целостное представление о хромосомной теории наследственности; механизме кроссинговера; классификации генетических карт, а также рассмотреть современные методы картирования.
Содержание:
Хромосомная теория наследственности
Кроссинговер
Генетические карты
Авторы: Беличенко Нина Ивановна, Лянгасова Ольга Владиславона
Хромосомная теория наследственности
Независимое комбинирование признаков (третий закон Менделя) осуществляется при условии, что гены, определяющие эти признаки, находятся в разных парах гомологичных хромосом. Следовательно, у каждого организма число генов, способных независимо комбинироваться в мейозе, ограничено числом хромосом. Однако в организме число генов значительно превышает количество хромосом. Например, у кукурузы изучено более 500 генов, у мухи дрозофилы - более 1 тыс., а у человека - около 2 тыс. генов, тогда как хромосом у них 10,4 и 23 пары соответственно. Это дало основание предположить, что в каждой хромосоме локализовано множество генов. Гены, локализованные в одной хромосоме, образуют группу сцепления и наследуются вместе. Число групп сцепления соответствует гаплоидному набору хромосом, поскольку группу сцепления составляют две гомологичные хромосомы, в которых локализованы одинаковые гены. У человека количество групп сцепления зависит от пола – женский пол – 23 группы сцепления, у мужчин – 24 группы сцепления, поскольку две половые хромосомы (Х и Y) не являются гомологичными и несут различный набор генов.
Предположение о том, что гены локализуются в хромосомах, появилось еще в начале ХХ века. Так в 1902 - 1903 годах американский цитолог У. Сеттон и немецкий цитолог и эмбриолог Т. Бовери независимо друг от друга выявили параллелизм в поведении генов и хромосом в ходе формирования гамет и оплодотворения. Однако экспериментальное доказательство локализации конкретных генов в конкретных хромосомах было получено только в 1910 г. американским генетиком Т. Морганом, который в последующие годы (1911 - 1926) обосновал хромосомную теорию наследственности. Согласно этой теории, передача наследственной информации связана с хромосомами, в которых линейно, в определенной последовательности, локализованы гены. Таким образом, именно хромосомы представляют собой материальную основу наследственности.
|
|
|
Способ наследования сцепленных генов отличается от наследования генов, локализованных в разных парах гомологичных хромосом. Так, если при независимом комбинировании дигетерозигота АаВbобразует четыре типа гамет (АВ, Аb, аВ и аb) в равных количествах, то такая же дигетерозигота в случае сцепления генов А и В образует только два типа гамет: (АВ и аb) тоже в равных количествах. Последние повторяют комбинацию генов в хромосоме родителя.
Однако полное сцепление генов наблюдается достаточно редко, и в потомстве обычно бывают представлены все четыре фенотипа. Таким образом, и в этом случае при дигибридном скрещивании образуются новые сочетания признаков – рекомбинантные фенотипы. Было установлено, однако, что кроме обычных гамет в этом случае возникают и другие - Аb и аВ – то есть появляются гаметы с новым сочетанием (комбинацией) аллелей, отличающимися от родительской гаметы. Причиной возникновения новых гамет является обмен участками гомологичных хромосом, или кроссинговер. Если особи с новыми генными комбинациями встречаются в потомстве реже, чем особи с родительскими фенотипами, то это верный признак сцепленности соответствующих генов.
Анализ явлений сцепленного наследования, кроссинговера, сравнение генетической и цитологической карт позволяют сформулировать основные положения хромосомной теории наследственности:
|
|
|
Гены локализованы в хромосомах. Разные хромосомы содержат неодинаковое число генов. Набор генов каждой из негомологичных хромосом уникален.
Аллельные гены занимают одинаковые локусы в гомологичных хромосомах.
Гены расположены в хромосоме в линейной последовательности.
Гены одной хромосомы образуют группу сцепления, благодаря нему происходит сцепленное наследование некоторых признаков. Сила сцепления находится в обратной зависимости от расстояния между генами.
Каждый биологический вид характеризуется определенным набором хромосом - кариотипом.
Авторы: Беличенко Нина Ивановна, Лянгасова Ольга Владиславона
Кроссинговер
Кроссинговер происходит в профазе I мейоза в пахитену (рис. 10.1). Обязательным условием для осуществления кроссинговера является конъюгация хромосом и образование синаптонемального комплекса. Объединенные синаптонемальным комплексом в бивалент гомологичные хромосомы, а точнее сестринские хроматиды гомологичных хромосом могут перекрещиваться и обмениваться своими участками, что приводит к образованию хиазм (рис. 10.2).

Рисунок 10.1 Кроссинговер между гомологичными хромосомами при конъюгации в мейозе
В результате возникают качественно новые хромосомы, содержащие участки (гены) как материнских, так и отцовских хромосом. Особи, которые получаются из таких гамет с новым сочетанием аллелей, получили название кроссоверных или рекомбинантных.

Рисунок 10.2. Образование хиазмы в результате кроссинговера
В биваленте из 4 хроматид в кроссинговере участвуют две, то есть процесс идет на хроматидном уровне, а не на хромосомном (рис. 10.3).
Для осуществления кроссинговера необходимо возникновение разрывов в ДНК. Согласно концепции Холлидея рекомбинация осуществляется при согласованном внесении разрывов и воссоединении цепей двух спиралей ДНК с образованием протяженных гетеродуплексных областей (рис. 10.4).

Рисунок 10.3 Схема кроссинговера: I — отсутствие кроссинговера; 2 - кроссинговер на стадии двух хромосом; 3 - кроссинговер на стадии четырех хроматид.
|
|
|
Первичным событием является возникновение одноцепочечных разрывов в цепях ДНК одинаковой направленности. Соответствующие цепи обоих линейных гомологичных дуплексов ДНК надрезаются и свободные концы одной спирали спариваются с комплементарными участками другой. Образуется структура, называемая полухиазмной. Перекрест стабилизируется сшиванием концов донорных цепей со свободными концами реципиентных спиралей. Точка перекреста обменивающихся цепей перемещается вдоль спиралей – процесс, называемый миграцией ветви. При этом происходит одновременное расхождение цепей исходных спиралей и их реассоциация с новыми партнерами с образованием дочерних дуплексов.
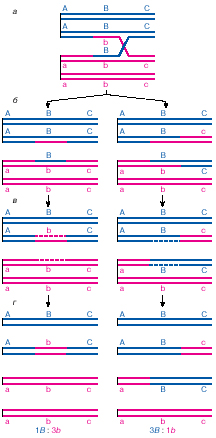
Рисунок 10.4. Упрощенная схема кроссинговера и конверсии по Холлидею (линии соответствуют цепям ДНК, две параллельные линии - хроматиде. Синий и красный цвета позволяют различать гомологов. Вертикальные линии слева обозначают центромеры, удерживающие сестринские хроматиды. Пара синих и пара красных сестринских хроматид образует тетраду. Более детально модель Холлидея представлена в [1]; а - полухиазма Холлидея, сформированная в результате обмена цепями между двумя хроматидами с последующей миграцией ветвления; б - два типа продуктов рекомбинации, возникшие в результате двух способов разрешения полухиазмы. Слева структуры с гетеродуплексом, но без кроссинговера по внешним маркерам. Справа структуры с гетеродуплексом и кроссинговером по внешним маркерам; в - в левой тетраде происходит конверсия от В к b, в правой - от b к В. Направление конверсии в тетрадах выбрано произвольно. Также произвольно выбрана и стадия, на которой происходит конверсия. Она может осуществляться и раньше, до разрешения полухиазмы; г - продукты рекомбинации)
Структуры Холлидея могут переходить в рекомбинантные двойные спирали путем внесения разрыва и воссоединения цепей двумя альтернативными способами. Один способ состоит в разрезании и воссоединении перекрещивающихся цепей. Два реципрокных продукта могут образоваться, если разрыв и последующее воссоединение цепей произойдут в точке перекреста или по линии пересечения четырех цепей в изомерной структуре Холлидея. Размер обменивающихся фрагментов зависит от расстояния, на которое произошла миграция ветви до акта рекомбинации.
|
|
|
В основе рекомбинации данного типа лежит гомологичное спаривание цепей, принадлежащих двум разным спиралям ДНК, поэтому скорее всего она произойдет в том месте, где такое спаривание возможно a priori и где гомологичность последовательностей достаточно велика, чтобы могла произойти миграция ветви в рамках структуры со скрестившимися цепями. Отсюда можно понять, почему общая, или гомологичная, рекомбинация происходит также между двумя повторами в пределах одной молекулы ДНК или между аллельными и неаллельными элементами одной и той же последовательности в двух разных хромосомах.
В ходе миграции ветви при спаривании цепей, принадлежащих разным спиралям, образуются гетеродуплексы. В таких гетеродуплексах в пределах сегмента между сайтом начала образования структуры Холлидея и сайтом кроссинговера может содержаться по одному или более ошибочно спаренных оснований. Они удаляются так же, как любые модифицированные основания при репарации ДНК. Однако, поскольку удалено может быть любое из ошибочно спаренных оснований, в обеих рекомбинантных спиралях в данном сайте могут оказаться одинаковые пары оснований, т.е. рекомбинация для этого сайта окажется нереципрокной. Таким образом, каждая из рекомбинантных спиралей может быть похожа на любой из начальных дуплексов в тех позициях, где исходно они различались.
Образование ошибочных пар (гетеродуплексов) в районах, фланкирующих брешь, обусловливает получение как реципрокных, так и нереципрокных рекомбинаций между генетическими маркерами. Если двухцепочечный разрыв происходит вблизи (или в пределах) участка, где между спиралями имеются различия (замены оснований, делеции, вставки, инверсии и т.п.), то рекомбинанты унаследуют нуклеотидную последовательность партнера, у которого разрыва не происходило. Этот механизм объясняет многие случаи генной конверсии, особенно те, в которых протяженная последовательность одного дуплекса замещается соответствующей, но отличающейся последовательностью другого дуплекса.
Кроссинговер еще больше увеличивает вероятность рекомбинации генов, тем самым увеличивая генетическое разнообразие потомства. Благодаря механизмам рекомбинации, гены матери и отца лишь временно сочетаются в организме потомка, чтобы вновь разойтись уже в его половых клетках и дать новые сочетания в его детях и т.д. (рис. 10.5).
|
|
|
Рекомбинация является основным источником генетической изменчивости в популяции. Если учесть, что в каждой клетке человека не две пары хромосом, как схематических примерах, а 23 пары, то можно представить себе, насколько велико число разнообразных сочетаний хромосом и генов, возникающих в результате рекомбинации. Поэтому уже одна только рекомбинация хромосом и генов настолько увеличивает генетическое разнообразие, что во всей человеческой популяции практически нет двух генетически одинаковых людей (не считая, конечно, монозиготных близнецов, которые по своему происхождению генетически идентичны).

Рисунок 10.5. Результаты кроссинговера по маркерным участкам хромосом человека. (Две гомологичные хромосомы человека (сплошная и пунктирная линии) показаны до и после кроссинговера при мейозе. Больной гетерозиготен по гену, вызывающему болезнь, поэтому у него один аллель нормальный (белый квадрат), а другой - мутантный (темный квадрат), и гетерозиготен по четырем генетическим маркерам-аллели A/В, F/G, К/L и R/S на расстоянии 0, 1, 10 и более 50 сМ от гена. Обследование семьи на аутосомно-доминантную болезнь. Вверху показано расположение двух генетических маркеров на 4-й и 7-й хромосомах каждого из родителей. Один маркер, представленный аллелями К/L, расположен на 4-й хромосоме на расстоянии 10 сМ от гена, вызывающего болезнь, а другой, представленный аллелями Y/Z, расположен на 7-й хромосоме. Ниже показаны генотипы всех членов семьи. Все больные дети, кроме последнего, получили от отца мутантный аллель, сцепленный с аллелем L генетического маркера. У последнего ребенка в результате кроссинговера (такого, как на рисунке А) мутантный ген сцеплен с аллелем К).
Ученые подсчитали, что число возможных сочетаний генов человека составляет примерно 3.1047, тогда как число живших на Земле людей за всю историю человечества имеет порядок около 1011, что на десятки порядков меньше. Поэтому практически на земном шаре никогда не было, нет и не может быть двух людей с одинаковым набором генов. Даже вероятность того, что дети одних и тех же родителей (не считая, конечно, монозиготных близнецов) будут иметь одинаковый набор генов, равняется одному шансу на 64 триллиона возможностей. Так что каждый из нас генетически уникален.
Генетические карты
Т. Морган и его сотрудники К. Бриджес, А. Стертеванти Г. Меллер экспериментально показали, что знание явлений сцепления и кроссинговера позволяет не только установить группу сцепления генов, но и построить генетические карты хромосом, на которых указаны порядок расположения генов в хромосоме и относительные расстояния между ними. Частота (процент) перекреста между двумя генами, расположенными в одной хромосоме, пропорциональна расстоянию между ними. Кроссинговер между двумя генами происходит тем реже, чем ближе друг к другу они расположены. По мере увеличения расстояния между генами все более возрастает вероятность того, что кроссинговер разведет их по двум разным гомологичным хромосомам.
Расстояние между генами характеризует силу их сцепления. Имеются гены с высоким процентом сцепления и такие, где сцепление почти не обнаруживается. Однако при сцепленном наследовании максимальная величина кроссинговера не превышает 50%. Если же она выше, то наблюдается свободное комбинирование между парами аллелей, не отличимое от независимого наследования.
Частота рекомбинаций определяется по формуле n=N/N0*100%, где N – количество рекомбинантов, N0– общее количество потомков. В то же время частота рекомбинаций определяет число рекомбинаций, происходящих при образовании гамет. Частота рекомбинаций генов показывает относительное расположение сцепленных генов в хромосоме: чем дальше друг от друга находятся гены, тем выше частота рекомбинации. Это обстоятельство используется при составлении генетических карт. Условное "расстояние" между локусами (местоположениями в хромосоме) двух генов считается прямо пропорциональным частоте рекомбинации (рис. 10.6). Взаимное расположение (последовательность) локусов трёх и более генов определяется методом триангуляции. При этом сначала берутся гены с наименьшей частотой рекомбинации. Далее выбирают следующую по величине частоту рекомбинации и указывают два возможных положения нового гена; одно из этих положений будет отсеяно на следующем шаге, когда берётся третья частота.

Рисунок 10.6. Построение генетической карты для генов A, B, C, частоты рекомбинаций между которыми составляют A – B = 6 %, B – C = 14 %, A – C = 8 %
В реальных экспериментах генетические карты могут искажаться благодаря двойному кроссинговеру, когда рекомбинация происходит одновременно в двух точках. Двойной кроссинговер особенно характерен для генов, локусы которых разделены большими расстояниями.
Генетической картой хромосом называют схему взаимного расположения генов, находящихся в одной группе сцепления. Такие карты составляются для каждой пары гомологичных хромосом.
Возможность подобного картирования основана на постоянстве процента кроссинговера между определенными генами. Генетические карты хромосом составлены для многих видов организмов: насекомых (дрозофила, комар, таракан и др.), грибов (дрожжи, аспергилл), для бактерий и вирусов.
Наличие генетической карты свидетельствует о высокой степени изученности того или иного вида организма и представляет большой научный интерес. Такой организм является прекрасным объектом для проведения дальнейших экспериментальных работ, имеющих не только научное, но и практическое значение.
Генетические карты человека также могут оказаться полезными в здравоохранении и медицине. Знания о локализации гена в определенной хромосоме используются при диагностике ряда тяжелых наследственных заболеваний человека (рис. 10.7). Уже теперь появилась возможность для генной терапии, т. е. для исправления структуры или функции генов.

Рисунок 10.7. Генетическая карта хромосомы 4 человека
Хромосомные карты генома человека получают локализацией генетических маркеров на индивидуальных хромосомах с использованием цитогенетических методов, включая авторадиографию и FISH. Радиоактивная или флуоресцентная метки, ассоциированные с исследуемыми генетическими локусами интактных хромосом, выявляются с помощью световой микроскопии. Методы гибридизации in situ с использованием метафазных хромосом, главным образом, метод FISH, локализуют полинуклеотидные маркеры в пределах 2-5 м.п.о. Более того, при гибридизации in situ с интерфазными хромосомами, в которых генетический материал находится в менее компактной форме, разрешающая способность хромосомных карт приближается к 100 т.п.о.
Известно, что геном человека насчитывает около 80000 генов, состоящих в сумме примерно из 3 млрд. пар нуклеотидов. Локализовано же всего 7000 генов – меньше 10%. Для некоторых районов генома, представляющих особый интерес, составлены довольно детальные карты, для остальных – весьма приблизительные либо вовсе никаких. Карты генома можно строить в разном масштабе, с различным уровнем разрешения – последний зависит от точности метода анализа (рис. 10. 8).

Рисунок 10.8. варианты картирования генома (а – карта генетического сцепления, б – участок хромосомы, составленный из последовательности рестрикционных карт, в – геномная библиотека, упорядоченная путем картирования контиг, г – последовательности нуклеотидов, прочитанная секвенированием).
Существует две разновидности карт генома – собственно генетические, получаемые косвенными методами, и физические – результат прямого исследования молекулы ДНК (рис. 10.9). Максимально возможная степень детализации – с точностью до пары нуклеотидов. Иными словами, самая крупномасштабная карта – полная последовательность нуклеотидов с указанием, где кончается один ген и начинается следующий. Но это предел мечтаний, и пока до него далеко. А то, чем мы сегодня располагаем, - главным образом мелкомасштабные карты всех 23 пар человеческих хромосом с расстоянием между отдельными маркерами – мельчайшими "различимыми на местности объектами" – 7-10 млн. п.н.
В отличие от генетических карт сцепления физические карты генома отражают реальное расстояние между маркерами, выражаемое в парах оснований. Главной задачей проекта " Геном человека " было создание детальной физической карты генома. С практической точки зрения это означало, что необходимо иметь набор хорошо охарактеризованных маркеров, перекрывающих весь геном человека с определенной частотой. В качестве маркеров можно использовать либо сами гены, либо охарактеризованные каким-либо образом фрагменты ДНК. В качестве таких маркеров могут использоваться рестриктные сайты, клонированные последовательности ДНК, известные гены.

Рисунок 10.9. Физические карты генома человека
В принципе возможны два принципиально различных вида карт - карты распределения маркеров и "карты контигов", т.е. набор клонированных последовательностей, перекрывающих определенную область генома, взаимное расположение которых известно.
При построении карт генома человека высокого разрешения экспериментально реализуются два альтернативных подхода, получивших названия картирования сверху вниз (top-down mapping) и картирования снизу вверх (bottom-up mapping) (рис. 10.10).
При картировании сверху вниз исходным в анализе является препарат ДНК индивидуальной хромосомы человека. ДНК разрезается крупнощепящими рестриктазами (например, NotI) на длинные фрагменты, которые после разделения электрофорезом в импульсном электрическом поле подвергаются дальнейшему рестрикционному анализу с другими рестриктазами. В результате получают макрорестрикционную карту, на которой достаточно полно представлены все последовательности исследуемой хромосомы или ее части, однако ее разрешение невысоко (рис. 10.11). На такой карте очень трудно локализовать индивидуальные гены. К тому же каждая индивидуальная карта редко охватывает протяженные сегменты ДНК (как правило, не более 1-10 м.п.о.).

Рисунок 10.10. Крупномасштабные физические карты генома (а – "сверху вниз", б – снизу вверх").

Рисунок 10.11. Построение рестрикционной карты
При картировании генома человека снизу вверх на основе препарата суммарной ДНК генома или индивидуальной хромосомы получают серию случайных клонов протяженных последовательностей ДНК (10-1000 т.п.н), часть из которых перекрывается друг с другом. В качестве вектора для клонирования в этом случае часто используют искусственные минихромосомы бактерий (BAC) или дрожжей (YAC). Серия частично перекрывающихся и дополняющих друг друга клонов образует непрерывную состыкованную последовательность нуклеотидов ДНК, получившую название контига (contig). Правильность полученных контигов подтверждают гибридизацией in situ (FISH) с одновременной их привязкой к определенным участкам исследуемых хромосом. Карты, основанные на контигах, представляют полную информацию о структуре отдельных сегментов хромосом и позволяют локализовать отдельные гены. Однако такие карты трудно применять для реконструкции целых хромосом или протяженных их участков из-за отсутствия соответствующих клонов в имеющихся клонотеках генов.
Многие гены в геноме эукариот располагаются в виде кластеров, члены которых функционально или эволюционно связаны друг с другом. В связи с этим в молекулярной генетике часто возникает задача клонирования генов, расположенных по соседству с уже выделенными генами. Для ее решения был разработан метод "прогулки по хромосоме". Из клонотеки генов, полученной на основе фаговых или космидных векторов, выделяют ген и короткие 5'- и 3'- концевой фрагменты его последовательности используют в качестве зондов для поиска фрагментов ДНК, перекрывающихся с этим геном. Основным требованием, предъявляемым к зонду, является принадлежность его к уникальной последовательности нуклеотидов, т.е. встречающейся в геноме только один раз. С помощью "прогулки по хромосоме" удается детально картировать участки ДНК длиной до 250 т.п.о.
Метод "прыжков по хромосоме" позволяет стыковать за один прием фрагменты ДНК общей длиной от 100 до 500-1000 т.п.о. На первом этапе препарат высокомолекулярной ДНК расщепляют соответствующей рестриктазой и с помощью электрофореза в импульсном электрическом поле получают фракцию фрагментов ДНК одинакового размера. Затем фрагменты ДНК лигируют с маркерным геном, например, геном устойчивости к антибиотикам, что приводит к образованию кольцевых молекул. Кольцевые молекулы ДНК расщепляют другой рестриктазой, для которой отсутствуют сайты рестрикции в маркерном гене, что сопровождается образованием коротких фрагментов ДНК, которые далее можно клонировать способами. Полученную клонотеку фрагментов ДНК исследуют с использованием гибридизации с зондом, комплементарным точке начала "прыжка по хромосоме". Отобранные в результате гибридизации клоны содержат маркерный ген, фланкированный изучаемыми последовательностями нуклеотидов, удаленными друг от друга на 100 т.п.о. Таким образом, получают информацию о последовательностях нуклеотидов, удаленных от точки начала "прыжка по хромосоме" на 100 т.п.о., и эти последовательности далее используют в качестве зонда для выделения и исследования фланкирующих ее фрагментов ДНК.
В 1987 году A. Poustka с соавт. И Collins с соавт. предложили использовать редкощепящие рестриктазы для получения двух библиотек, одна из которых ("связывающая" ("linking")) состоит из клонов, содержащих сайт расщепления редкощепящих рестриктаз, а другая ("прыгающая" ("jumping")) состоит из фрагментов, расположенных на концах рестриктных фрагментов, образуемых при расщеплении геномной ДНК. Связывающие библиотеки широко применяются для построения рестриктных карт хромосом. Достоинством этого метода является то, что позволяя доказать соседство двух рестриктных фрагментов, они позволяют получать полные рестриктные карты хромосом при использовании относительно небольшого числа клонов. Так, например, полный набор NotI-связывающих клонов для хромосомы 21 состоял бы из 50 клонов. При этом создание и анализ такой библиотеки дает дополнительную информацию, превращая просто рестриктную карту в карту рестриктных сайтов-STS (STARS от Sequence Tagged Are Restriction Sites по терминологии).
При анализе "связывающей" и "прыгающей" библиотек, полученных из одного района генома, можно однозначно реконструировать порядок расположения рестриктных сайтов. Действительно, если в "связывающей" библиотеке клонированная ДНК перекрывает рестриктный сайт, а в "прыгающей" состоит из половинок, находящихся на противоположных концах рестриктных фрагментов, то при секвенировании достаточного количества клонов из обоих библиотек можно путем сравнения последовательностей определить порядок взаимного расположения рестриктных сайтов в геномной ДНК.
Другим важным методом клонирования определенных областей генома является метод микродиссекции. Этот метод был предложен в 1981 г. F. Scalenghe с соавт. для картирования специфических последовательностей политенных хромосом Drosofila melanogaster. Суть метода заключается в том, что из метафазных хромосом под микроскопом вырезают интересующий участок, который затем клонируют, получая специфическую для данного района библиотеку. В 1986 г. G.P. Bates с соавт. смогли применить метод микродиссекции для исследования генома человека. Авторы этой работы получили библиотеку последовательностей дистальной части короткого плеча хромосомы 2 человека в векторе gt10. 41% из 257 потенциальных рекомбинантов содержали человеческие вставки, из которых высокоповторяющиеся последовательности содержались менее, чем в 10% клонов. Все уникальные последовательности из этой библиотеки были картированы на коротком плече хромосомы 2, подтверждая специфичность полученной библиотеки. Таким образом, было доказано, что микродиссекция является достаточно быстрым и эффективным методом получения библиотек, специфичных для определенных хромосомных участков.
Секвенирование ДНК
Современным методом определения нуклеотидной последовательности ДНК является метод обрыва цепи (англ. chain termination method). Прежде всего фрагмент ДНК клонируют в фаге М13, из которого легко выделяют однонитевую ДНК (рис. 10.12а). Ее гибридизуют с короткой ДНК, называемой праймером, которая связывается с 3'-концом однонитевой ДНК (б). Затем к полученной матрице добавляют четыре дезоксирибонуклеозидтрифосфата дНТФ (dNTP): дАТФ (dATP), дГТФ (dGTP), дТТФ (dTTP) и дЦТФ (dCTP). Кроме дезоксирибонуклеозидтрифосфатов в реакционную смесь добавляют один из четырех дидезоксирибонуклеозидтрифосфатов [ддНТФ (ddNTP)]схему). Затем с помощью ДНК-полимеразы ведут синтез второй (комплементарной) цепи ДНК. Остановка синтеза (обрыв цепи) будет происходить всякий раз, когда вместо дНТФ в растущую цепь ДНК будет

Рисунок 10.12. Схема секвенирования ДНК
встраиваться соответствующий ему ддНТФ. На схеме принцип метода демонстрируется на примере с ддГТФ. В этом случае образуются фрагменты, которые включают праймер плюс 3, 6, 8, 13 или 14 других нуклеотидов. Для определения последовательности нуклеотидов необходимо поставить 4 отдельные реакции в присутствии каждого из четырех ддНТФ (в). Затем четыре пробы вносят в соседние лунки пластины геля и проводят гель-электрофорез (г). Длина пробега каждого компонента обратно пропорциональна длине цепи.
Как только фрагменты ДНК визуализированы (д), нуклеотидную последовательность можно прочесть прямо в геле снизу по направлению к старту в соответствие с очередностью, в которой фрагменты располагаются на отдельных "дорожках" (е). При оптимальных условиях с помощью метода обрыва цепи можно в одном эксперименте определить строение фрагмента, включающего сотни нуклеотидов.
|
|
|


