 |
Методы получения моносахаридов.
|
|
|
|
Введение
Углеводы – полифункциональные соединения, широко распространенные в растительном и животном мире; они выполняют исключительную роль во многих жизненных процессах. Углеводы составляют 80% от сухой массы растений и 2% от сухой массы животных организмов.
Название "углеводы" предложил в 1844 году русский химик К. Шмидт, исходя из того, что эти вещества по составу формально отвечают соединению углерода с водой, общей формулы Сn(H2O)n. Например, если n=6, то мы получаем формулу глюкозы C6(H2O)6 = C6H12O6. В дальнейшем стало известно, что не все углеводы соответствуют этой формуле. Однако название "углеводы" сохранилось.
Значение углеводов очень велико. Они являются одним из важнейших продуктов питания человека, животных и других организмов. Углеводы позволяют всем компонентам живого организма – нуклеиновым кислотам, белкам, липидам – нормально функционировать. Углеводы нас защищают, согревают, помогают двигаться и выполнять множество важных функций. Природа постоянно создает углеводы.
В растениях углеводы образуются из оксида углерода (IV) и воды в процессе фотосинтеза, осуществляемого с участием хлорофилла за счет солнечной энергии:
 Животные организмы не способны синтезировать углеводы, а получают их с пищей растительного
Животные организмы не способны синтезировать углеводы, а получают их с пищей растительного 
 происхождения и используют в значительной степени для выработки энергии для жизнедеятельности путем окисления:
происхождения и используют в значительной степени для выработки энергии для жизнедеятельности путем окисления:
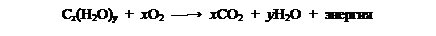
Классификация углеводов.
Углеводы обычно подразделяют по способности к гидролизу на моносахариды, олигосахариды и полисахариды (схема 1). Моносахариды не гидролизуются, а олиго- и полисахариды, способные к гидролизу, можно рассматривать как продукты поликонденсации моносахаридов.
|
|
|
Моносахариды – это простые углеводы или монозы. Моносахариды не могут гидролизоваться и превращаться в более простые углеводы.
Химический состав моносахаридов выражается общей формулой:

По числу углеродных атомов (n) в молекуле моносахариды (монозы) подразделяются на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т.д. Окончание – оза указывает на принадлежность вещества к классу углеводов.
Полисахариды – это сложные углеводы или полиозы, построенные из большого числа остатков моносахаридов (n).
Химический состав полисахаридов выражается общей формулой:

В свою очередь полисахариды делят на две группы:
а)сахароподобные углеводы или олигосахариды (греческое "oligos" – немногий), в состав молекул которых входит от 3 до 20 остатков моносахаридов. При гидролизе олигосахаридов образуется соответствующее число тех же моносахаридов. К этой группе относятся, например дисахариды – сахароза, лактоза, целлобиоза и др.;
б)несахароподобные или высокомолекулярные полисахариды, образующиеся поликонденсацией моносахаридов. Полисахариды имеют молекулярную массу от 104 до 109. Полный гидролиз полисахаридов приводит к образованию соответствующих моносахаридов. Полисахариды, состоящие из остатков моносахарида одного вида, называются гомополисахаридами. Если полисахарид состоит из моносахаридов двух видов или более, его называют гетерополисахаридом. К высокомолекулярным полисахаридам (гомополисахаридам) относятся, прежде всего, крахмал, гликоген, клетчатка.
КЛАССИФИКАЦИЯ УГЛЕВОДОВ
| УГЛЕВОДЫ |
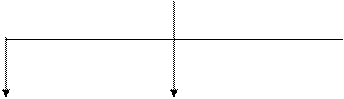

| МОНОСАХАРИДЫ (простые углеводы или монозы) | ОЛИГОСАХАРИДЫ (дисахариды, трисахариды, тетрасахариды и т.д.) | ПОЛИСАХАРИДЫ (высокомолекулярные полисахариды или полиозы) |
| Альдозы | Кетозы | Гомо- полисахариды | Гетеро- полисахариды |


|
|
|
Схема 1.
 2. Моносахариды (монозы).
2. Моносахариды (монозы).
В моносахаридах неразветвленная цепь атомов углерода включает от 3 до 10 атомов. В природе распространены и имеют наибольшее значение пентозы С5Н10О5 и гексозы С6Н12О6. По химическому строению моносахариды представляют собой многоатомные спирты, имеющие альдегидную группу (альдегидоспирты или оксиальдегиды) или кетонную группу (кетоспирты или оксикетоны). Первые называются – альдозы, а вторые – кетозы.
Изомерия моносахаридов.
Для моносахаридов как гетерофункциональных соединений характерны разнообразные виды изомерии.
Структурная изомери я – изомерия характера функциональной группы. Функциональными изомерами являются альдозы и кетозы. В молекуле альдоз карбонильная группа входит в состав альдегидной группы Н – С = О, в молекуле кетоз – в ½
состав кетогруппы – С = О.
½ Например, глюкоза и фруктоза являются функциональными изомерами.
Пространственная изомерия. Функциональные изомеры различаются и расположением гидроксильных групп, как это видно из сравнения структур глюкозы и галактозы. Такие пространственные изомеры называются диастереомерами. Они различаются физическими и химическими свойствами.

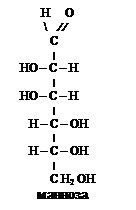


Оптическая изомерия. Для моносахаридов характерна оптическая изомерия (оптическая стереоизомерия). В молекулах моносахаридов содержатся асимметрические (хиральные) атомы углерода (С*), находящиеся в sp3 -гибридизации и связанные с четырьмя различными атомами или группами. Оптические, или зеркальные, изомеры называют энантиомерами. Энантиомеры имеют идентичные физические и химические свойства. Число оптических стереоизомеров связано с числом асимметрических атомов углерода формулой N = 2n.

 Например, для альдогексоз карбонильной формы, где количество асимметрических атомов углерода (С*) равно четырем (n = 4), количество оптических изомеров равно 16 (N = 24 = 16) или 8 пар зеркальных изомеров (антиподов).
Например, для альдогексоз карбонильной формы, где количество асимметрических атомов углерода (С*) равно четырем (n = 4), количество оптических изомеров равно 16 (N = 24 = 16) или 8 пар зеркальных изомеров (антиподов).
Для обозначения многочисленных стереоизомеров используют проекционные формулы, предложенные немецким ученым Эмилем Фишером.
В качестве обозначения противоположных конфигураций углеводов с одинаковыми названиями применяются буквы D и L, которые указывают принадлежность к двум рядам, например:
|
|
|


Весь стереохимический D-ряд моносахаридов – до гексоз включительно можно изобразить схемой (схема 2).
Поскольку молекулы моносахаридов построены несимметрично, то для них не существует оптически неактивных мезоформ. Так, известны D(+) – и L(-) – глюкоза, являющиеся зеркальными изображениями одной по отношению к другой.



D-ряд альдоз


Т е т р о з ы




П е н т о з ы П е н т о з ы










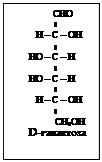
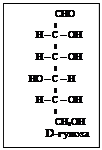

 Схема 2
Схема 2
Экспериментальный факт, фиксируемый поляриметром, вращения поляризованного света вправо обозначается знаком (+); вращение влево – знаком (-). Символы знаков D(+) – и L(-) могут очень часто не совпадать. Отношение изомеров к D- или L-ряду по предложению русского химика А.М. Розанова в 1906 году основано на получении моносахаридов из соответствующего оптически активного глицеринового альдегида путем надстройки углеродной цепи. Молекула глицеринового альдегида имеет один асимметрический атом углерода (С*). Конфигурацию стереоизомера, у которого группа –ОН находится по правую сторону асимметрического атома углерода назвали D- глицериновый альдегид. Соответственно, зеркальное изображение D-глицеринового альдегида (антипода) назвали L-глицериновым альдегидом с группой –ОН, находящейся по левую сторону асимметрического атома углерода (С*).


Позже (1951 г.) конфигурации D- и L-глицеринового альдегида были подтверждены.
Моносахариды, полученные из D-глицеринового альдегида путем надстройки углеродной цепи со стороны альдегидной группы, условились относить к D-ряду независимо от знака вращения поляризованного света. Соответственно, моносахариды, полученные из L-глицеринового альдегида относят к L-ряду. На схеме 2 приведены альдозы D-ряда, образованные из D-глицеринового альдегида. Такое же число альдогексоз существует и для L-ряда.
Все моносахариды растительного происхождения относятся к D-ряду.
|
|
|
Кольчато-цепная (цикло-оксо-) таутомерия.
Изображенные линейными формулами альдозы (схема 2) во многом не отражают физические и химические свойства моносахаридов. Такие структуры возможны в растворах и то в незначительных количествах (тысячные доли процента). Так в УФ- и ИК-спектрах моносахаридов отсутствуют полосы поглощения, характеризующие карбонильную группу. Гексозы, например глюкоза, не дают реакций типичных для альдегидной группы, в частности, не обесцвечивают раствор фуксинсерной кислоты, не вступают в реакции с бисульфитом натрия и др.
Как показал А.А. Колли (русский химик-органик), в глюкозе, как и в других альдогексозах, не четыре, а пять гидроксилов. Колли предложил для всех моносахаридов циклические структуры. Появление пятого гидроксила, названного гликозидным, является следствием внутримолекулярной реакции между карбонильной группой и одним из гидроксилов моносахарида. Известно, что взаимодействие альдегидов со спиртами приводит к образованию  полуацеталей.
полуацеталей.
Например, образование полуацетальной формы глюкозы происходит вследствие взаимодействия альдегидной группы с гидроксилом при пятом атоме углерода, в результате образуется шестичленный цикл - глюкопираноза (название от
гетероцикла пиран 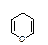 ), состоящий из пяти атомов углерода и одного атома кослорода. Если же цикл образуется с участием гидроксильной группы при четвертом атоме углерода, то образуются производные пятичленного кислородсодержащего
), состоящий из пяти атомов углерода и одного атома кослорода. Если же цикл образуется с участием гидроксильной группы при четвертом атоме углерода, то образуются производные пятичленного кислородсодержащего
гетероциклического соединения - фурана

 альдегидная форма
альдегидная форма
глюкозы
Таким образом, пятичленные монозы называются фуранозами (2), а шестичленные пиранозами (1). Возникновение циклических структур, существование которых предвидел Колли, обусловлено g- и d-оксициклотаутомерией.
Для более реального изображения моносахаридов как циклических полуацеталей используют перспективные формулы, предложенные в 1925 году английским химиком-органиком, лауреатом Нобелевской премии Н. Хеуорсом. Для перехода от проекционных формул Фишера к перспективным формулам Хеуорса поступают следующим образом. Все группы, которые в проекционной формуле Фишера расположены слева от углеродного скелета, в формуле Хеуорса располагаются сверху, а те группы, которые расположены в проекционной формуле Фишера справа от углеродного скелета, в формуле Хеуорса располагаются внизу. При этом гликозидный гидроксил может располагаться под плоскостью цикла рядом с гидроксилом при втором атоме углерода (в цис -положении). Такая структура отвечает α-D-глюкопиранозе (формула 1). Равновероятно, что в процессе образования полуацеталя может возникнуть структура, в которой гликозидный гидроксил может находиться в транс -положении по отношению к гидроксилу при втором атоме углерода, т.е. располагаться над плоскостью цикла. Такая структура отвечает β-D-глюкопиранозе (формула 2). α-D- и β-D-глюкопиранозы являются аномерами (от греческого ano – вверх). Аномеры – это изомеры циклических форм углеводов, отличающихся пространственным расположением гликозидных (полуацетальных) гидроксилов по отношению к плоскости цикла.
|
|
|
Циклические формулы углеводов изображают, по предложению Хеуорса, перспективными формулами.

D-глюкоза
(карбонильная форма)
1 - a-D-глюкопираноза, [a]D = +1120
2 - b-D-глюкопираноза, [a]D = +18,70
Присоединение гидроксила к карбонильной группе превращает ее атом углерода в асимметрический атом, следовательно, число оптических изомеров увеличивается в 2 раза: N = 25 = 32.
Аномеры α-D- и β-D-глюкопиранозы одновременно являются диастереомерами (пространственными изомерами), которые различаются свойствами, прежде всего, величинами углов удельного вращения [α]D поляризованного света. Оба изомера вращают поляризованный свет вправо, но на разные по величине углы. Поэтому глюкозу иногда называют декстрозой (от латинского dexter – правый).
Если в процессе образования полуацеталя участвовала гидроксильная группа при четвертом атоме углерода, то образуются α-D-глюкофураноза и β-D-глюкофураноза.
 b- D-глюкофураноза a-D-глюкофураноза
b- D-глюкофураноза a-D-глюкофураноза
Проекционные формулы Фишера для фруктозы имеют следующий вид:

D-(-)-фруктоза L-(+)-фруктоза
Образование циклических структур в случае D-фруктозы можно отобразить следующей схемой:
 a-D-фруктофураноза D-фруктоза a-D-фруктопираноза
a-D-фруктофураноза D-фруктоза a-D-фруктопираноза
(открытая форма)
Используя выше приведенное правило, переходим к перспективным формулам Хеуорса:

a-D(-)-фрукто- a-D-фруктопираноза b-D(-)-фрукто-
фураноза фураноза
[a]D = -63,60 [a]D = -135,50
α-D-фруктофураноза и β-D-фруктофураноза являются аномерами. В водных растворах фруктоза вращает поляризованный свет влево, поэтому ее еще называют левулеза.
Конформационная изомерия. Для моносахаридов полуацетальной структуры характерна конформационная (поворотная) изомерия, обусловленная различным расположением в пространстве атомов углерода, водорода и гидроксильных групп. Конформации (конформеры) полуацетальных моносахаридов представляют собой стереоизомерные структуры, находящиеся в подвижном равновесии, способные к различному превращению путем инверсии, выражающейся в выгибании и вращении вокруг σ-связей.
Циклы в ряду альдопираноз, подобно циклогексановому кольцу не плоские и существуют в виде нескольких (восьми) конформеров, среди которых термодинамически наиболее устойчивыми являются конформации кресла. α-D- и β-D-глюкопираноза представляют собой кресловидные структуры, изображаемые конформационными формулами 3 и 4 соответственно.

(3) (4)
a-D-глюкопираноза b-D-глюкопираноза
По сравнению с α-D-глюкопиранозой (3), β-D-глюкопираноза (4) термодинамически более устойчива и количественно преобладает в растворе равновесной смеси. В глюкопиранозе (4) все гидроксильные группы расположены экваториально (конформация еееее), между ними конформационные силы отталкивания сведены к минимуму. В то время, как существование некоторой доли конформера (3) стерически менее выгодно из-за расположения гликозидного гидроксила в аксиальном положении (конформация аееее). В α-D-глюкопиранозе имеет место так называемый аномерный эффект Δ2, являющийся следствием диполь-дипольного отталкивания между гетерокислородом цикла и гликозидным гидроксилом, вынужденным занять аксиальное положение (а).
В кристаллическом состоянии моносахариды существуют исключительно в виде циклических полуацеталей. При растворении в воде или действии химических реагентов происходит таутомеризация, в результате которой образуются открытые формы (карбонильные структуры), переходящие в пиранозные или фуранозные формы моносахаридов.
Пространственные изменения структуры после растворения называются мутаротацией моносахарида. Ход мутаротации можно проследить по изменению оптической активности, величины удельного угла вращения раствора моносахарида (схема 3). На схеме 3 показаны таутомерные превращения глюкозы. Процесс мутаротации ускоряется добавками к раствору небольших количеств аммиака. Так, угол вращения свежеприготовленного раствора α-D-глюкопиранозы, равный +112,20, постепенно уменьшается, доходя до величины равной +52,70.
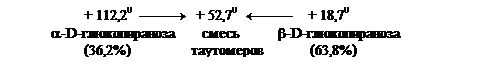
Аналогично угол удельного вращения свежеприготовленного раствора β-D-глюкопиранозы, равный +18,70, со временем возрастает, доходя до величины равной +52,70. В обоих случаях происходит мутаротация α-D- и β-D-глюкопиранозы соответственно. В результате в растворе устанавливается равновесная смесь, состоящая из α-D-глюкопиранозы (36,2%) и из термодинамически более устойчивой β-D-глюкопиранозы (63,8%).
Таутомерное превращение глюкозы.

1 – D(+)-глюкоза
2 - a-D-глюкопираноза - 36,2%
3 - b-D-глюкопираноза - 63,3%
4 - a-D-глюкофураноза
5 - b-D-глюкофураноза
Схема 3.
Методы получения моносахаридов.
Как уже отмечалось, углеводы различной сложности образуются естественным путем в растениях в процессе фотосинтеза. Химически моносахариды получают одним из следующих методов.
1.Ферментативный или кислотный гидролиз ди- и полисахаридов:
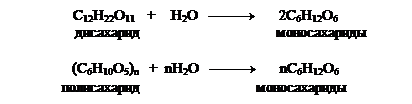 2.Неполное химическое или ферментативное окисление многоатомных спиртов. Например, при биологическом окислении под влиянием Acetobacter xylinum D-сорбит окисляется в L-сорбозу:
2.Неполное химическое или ферментативное окисление многоатомных спиртов. Например, при биологическом окислении под влиянием Acetobacter xylinum D-сорбит окисляется в L-сорбозу:

3.Конденсацией альдегидов и кетонов в слабощелочной среде. В принципе этим путем из простейшего альдегида – формальдегида – реакцией альдольной конденсации можно получить моносахариды, а из них - ди- и полисахарид. Этот чисто химический метод синтеза углеводов впервые в истории химии осуществил А.И. Бутлеров в 1861 году. Взаимодействием формальдегида (формалина) с известковой водой Бутлеров получил сахаристое вещество, которое он назвал метиленитан.

Потом было установлено, что метиленитан представляет собой смесь различных моносахаридов.
4.Методом циангидринового синтеза из низших моносахаридов можно получать моносахариды с более длинной углерод-углеродной цепью.
|
|
|


