 |
25 Термодинамический и кинетический признаки химического равновесия.
|
|
|
|
25 Термодинамический и кинетический признаки химического равновесия.
Обратимыми химическими реакциями называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в обратном направлении. Уравнение гипотетической обратимой реакции может быть представлено схемой:
аА + bВсС +dD
Химическое равновесие — это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой
Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ
- для прямой реакции в с. у. Δ G< 0, при этом Δ Н< 0 и Δ S< 0.
- для обратной реакции Δ G> 0, при этом Δ Н> 0 и Δ S> 0.
С ростом температуры для прямой реакции величина Δ G будет расти, а для обратной уменьшаться и в какой-то момент они сравняются и Δ G = 0 для обеих реакций. Наступает особое состояние системы, называемое химическим равновесием. =
Δ G = 0 – термодинамический критерий химического равновесия.
С точки зрения химической кинетики, в начальный момент времени скорость прямой реакции  = kпр  имеет максимальное значение, а  = 0, так как воды в системе нет. С течением времени концентрация исходных веществ уменьшаются, а концентрация продукта реакции (воды)  возрастает, следовательно, возрастает и скорость обратной реакции. В состоянии равновесия Vпр = Vобр и видимое течение реакции прекращается.
Vпр = Vобр - это кинетический критерий равновесия.
Равновесие не означает прекращение всех реакций в системе. На атомно-молекулярном уровне взаимодействие веществ продолжается: молекулы сталкиваются, образуют молекулы продуктов реакции, которые распадаются на исходные вещества. Но в любой момент времени сколько новых частиц образуется, столько и распадается.
|
|
|
26. Константа химического равновесия (закон действующих масс для химического равновесия).
С течением времени скорость (V) прямой реакции, которая пропорциональна произведению концентраций исходных веществ, будет уменьшаться, так как уменьшаются концентрации исходных веществ (Н2 и I2), а скорость обратной реакции, которая пропорциональна концентрации НI в квадрате, увеличивается, так как увеличивается концентрация НI. Наконец, наступит такой момент, когда Vпрямой = Vобратной, т. е. наступает состояние химического равновесия.
Устойчивые равновесия (в том числе и химические) характеризуются следующими общими признаками:
1. Неизменностью равновесного состояния системы при сохранении внешних условий.
2. Подвижностью равновесия
3. Динамическим характером равновесия, т. е. установлением и сохранением его вследствие равенства скоростей прямого и обратного процессов.
4. Возможностью подхода к состоянию равновесия с двух противоположных сторон (т. е. вводя только исходные вещества, либо только продукты реакции).
5. Минимальным значением G (или F или соответствующим экстремальным значением другой характеристической функции при иных путях проведения процесса).
Закон действующих масс для рассмотренной реакции, который формулируется следующим образом:
отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная для данной реакции.
27. Величина константы химического равновесия в зависимости от ее размерности и способа измерения концентрации.
|
|
|
Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов.
Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия. Если гомогенная реакция идет между веществами в растворе, то константа равновесия обозначается KС, а если между газами, то KР.
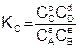
Если K > 1, то данная реакция протекает со значительным выходом продуктов реакции; если K > 104, то реакция необратима; если K < 1, то такая реакция нетехнологична; если K < 10-4, то такая реакция невозможна.
Зная константу равновесия, можно определить состав реакционной смеси в момент равновесия и рассчитать константу выхода продуктов реакции. Константу равновесия можно определить, используя экспериментальные методы, анализируя количественный состав реакционной смеси в момент равновесия, или применяя теоретические расчеты. Для многих реакций при стандартных условиях константа равновесия – это табличная величина.
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии МПа или 1 атм) может быть рассчитана по выражению:
Стандартная константа равновесия — безразмерная величина. Она связана с K соотношением:
Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям МПа или 1 атм. соотношением:
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
|
|
|
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CА или CВ ®; CС или CD; ¯ CА или CВ; ¯ CС или CD ®).
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Таким образом, в экзотермической реакции (+ Q) увеличение температуры приводит к сдвигу равновесия в обратном направлении и, наоборот, в эндотермической реакции (- Q) увеличение температуры приводит к сдвигу в прямом направлении, а уменьшение температуры – в обратном направлении. (Схематично можно записать: при +Q Т; ¯ Т ®; при -Q Т ®; ¯ Т ).
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Dn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Dn = 0, то давление не влияет на смещение химического равновесия; если Dn < 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Dn > 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. (Схематично можно записать: при Dn = 0 Р не влияет; при Dn < 0 Р®, ¯ Р; при Dn > 0 Р, ¯ Р ®). Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
|
|
|


