 |
28. Связь КС с Кр и КР. Принцип Ле-Шателье. Факторы, влияющие на смещение химического равновесия.
|
|
|
|
28. Связь КС с Кр и КР. Принцип Ле-Шателье. Факторы, влияющие на смещение химического равновесия.
принцип Ле-Шателье: если изменить одно из условий, при котором система находится в состоянии равновесия – концентрацию, давление или температуру, — то равновесие сместится в направлении той реакции, которая противодействует этому изменению.
Т. е. равновесие стремится к смещению в направлении, приводящему к уменьшению влияния воздействия, которое привело к нарушению состояния равновесия.
Состояние, при котором скорости прямой и обратной реакций равны между собой, называется химическим равновесием. Уравнение обратимой реакции в общем виде:
mA+nB  pC+qD
Скорость прямой реакции v1=k1[A]m[B]n, скорость обратной реакции v2=k2[С]p[D]q, где в квадратных скобках – равновесные концентрации. По определению, при химическом равновесии v1=v2, откуда
Кс =k1/k2 = [С]p[D]q / [A]m[B]n,
Факторы, влияющие на химическое равновесие.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам:
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом.
|
|
|
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Закон действующих масс может быть выражен через константы равновесия Кc, Кр и Кх которые связаны между собой.
а) Если все реагенты ХР- газообразные вещества, то закон действующих масс имеет вид

где 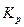 - константа равновесия, выраженная через парциальные давления.
- константа равновесия, выраженная через парциальные давления.
Выразим 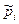 через молярные доли xi:
через молярные доли xi: 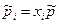 и подставим в:
и подставим в:
Тогда получим:
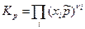
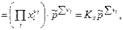
где 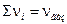 - стехиометрические коэффициенты только газообразных веществ; Кх – константа равновесия, выраженная через молярные доли:
- стехиометрические коэффициенты только газообразных веществ; Кх – константа равновесия, выраженная через молярные доли:
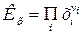
где 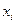 - молярные доли всех участников реакции.
- молярные доли всех участников реакции.
Связь Кх с Кр будет иметь вид:
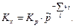
б) Выразим 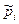 через молярные концентрации
через молярные концентрации 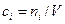 , моль/м3 и запишем уравнение состояния для i-го компонента смеси идеальных газов в виде:
, моль/м3 и запишем уравнение состояния для i-го компонента смеси идеальных газов в виде: 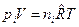 . Тогда получим
. Тогда получим 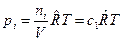 , или после деления на величину давления в одну физическую атмосферу:
, или после деления на величину давления в одну физическую атмосферу:

где 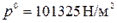 ;
;  , [м3/моль× К].
, [м3/моль× К].
После подстановки 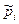 (выражение (14)) в (10) имеем:
(выражение (14)) в (10) имеем:
 =
= 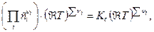
где Кс - константа равновесия, выраженная через молярные концентрации сi, равна:
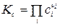
Тогда связь Кс с Кр будут иметь вид:
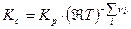
Таким образом связь между Кр , Кх и Кс имеет вид
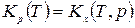
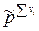 =
=  .
.
29. Связь энергии Гиббса с константой химического равновесия.
В химической термодинамике имеется соотношение, ĸ ᴏ ᴛ ᴏ ᴩ ᴏ ᴇ связывает энергию Гиббса с константой равновесия. Это широко известное уравнение Вант-Гоффа, ĸ ᴏ ᴛ ᴏ ᴩ ᴏ ᴇ записывается в линейном и экспотенциальном виде:
Рассчитав величину DG0298 химической реакции, можно определить константу равновесия
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (Δ GT) может быть рассчитана по уравнению:
|
|
|
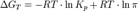
где 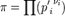 — отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная.
— отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при 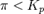
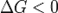 — реакция идёт в прямом направлении, слева направо;
— реакция идёт в прямом направлении, слева направо;
при 
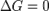 — реакция достигла равновесного состояния;
— реакция достигла равновесного состояния;
при 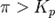
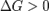 — реакция идёт в обратном направлении.
— реакция идёт в обратном направлении.
Стандартная константа равновесия связана со стандартной энергией Гиббса реакции соотношением:
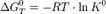
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0, 1013 МПа (1 атм).
|
|
|


