 |
58. Ионное произведение воды. Водородный и гидроксильный показатели.
|
|
|
|
58. Ионное произведение воды. Водородный и гидроксильный показатели.
Ионное произведение воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. 
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH− ]) найти соответственно концентрации [OH− ] или [H+].
Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: 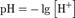 Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.
Водородный показатель имеет важное значение для жизнедеятельности организма, и отклонение его от нормы приводит к расстройству его деятельности. Также рН влияет на урожайность почвы и экологию водоемов.
По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10. По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.
|
|
|
59. Индикаторы. Вода: особенности строения и свойств. Активированная вода.
Активированной называется вода, обладающая повышенной биологической активностью. Повышенную биологическую активность имеет вода, насыщенная кислородом и его активными формами, и вода, насыщенная водородом.
Основным способом получения активированной воды была электрохимическая активация. Понятие «электрохимическая активация» появилось в 1974 году, когда было установлено, что вода, получающаяся после электролиза, обладает биологической активностью [2]. На аноде образуется вода, насыщенная кислородом, на катоде – водородом. Выяснили, что это разные сорта воды, и их влияние на живые организмы принципиально отличается. На аноде образуется вода, насыщенная кислородом и его активными формами. Из стабильных активных долгоживущих форм кислорода сейчас известна перекись водорода. Кислородная вода имеет повышенный окислительно–восстановительный потенциал (ОВП) по сравнению с обычной водой. Кислородная вода стимулирует химические процессы окисления, получения энергии. Поэтому кислородная вода бодрит, улучшает обмен веществ.
Молекула воды H2O несимметрична. Атомы водорода, несущие положительный заряд, смещены в одну сторону от центра молекулы, атом кислорода – в другую. В результате молекула воды представляет собой диполь: положительный заряд которого сосредоточен в одном конце молекулы, а отрицательный – в противоположном. Если молекулы окажутся ориентированными относительно друг друга разноимёнными полюсами, то они будут притягиваться
Кислотно-основными индикаторами называют вещества, меняющие свою окраску в определенной области значений рН раствора. Индикаторами могут быть слабые органические кислоты НInd и основания IndOH, молекулы и ионы которых имеют разную окраску. Будучи введенными в исследуемый раствор диссоциируют по одному из следующих механизмов
|
|
|
Так как процесс диссоциации слабых электролитов обратим, положение равновесия в системах зависит от кислотности исследуемого раствора. В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора HInd. Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в своей ионной форме Ind+, которая обуславливает окраску раствора
|
|
|


