 |
60. Ионные реакции. Обратимые и необратимые реакции. ПР.
|
|
|
|
60. Ионные реакции. Обратимые и необратимые реакции. ПР.
Ионные реакции – реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения.
Ионные реакции могут быть обратимыми и необратимыми:
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:
3H2 + N2 ⇆ 2NH3
Направление обратимых реакций зависит от концентраций веществ — участников реакции. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции.
Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость.
Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании
2КСlО3 > 2КСl + ЗО2,
Необратимыми называются такие реакции, при протекании которых:
1) образующиеся продукты уходят из сферы реакции - выпадают в виде осадка, выделяются в виде газа,
Na 2CO 3 + 2HCl = 2NaCl + CO2 ↓ + H2O
2) образуется малодиссоциированное соединение, например вода:
НСl + NаОН = Н2О + NаСl
3) реакция сопровождается большим выделением энергии, например горение магния
Произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная (табличная), называемая произведением растворимости.
|
|
|
Произведение растворимости позволяет регулировать процессы образования и растворения труднорастворимых веществ. Например, для 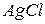 в зависимости от величины произведения концентраций ионов и, и сравнив ее с табличным значением произведения растворимости (
в зависимости от величины произведения концентраций ионов и, и сравнив ее с табличным значением произведения растворимости ( 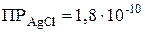 ), можно сделать следующие выводы:
), можно сделать следующие выводы:
§ если 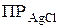 >
> 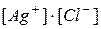 – то раствор ненасыщен, осадок не образуется;
– то раствор ненасыщен, осадок не образуется;
§ если 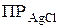 <
< 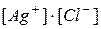 – раствор насыщен, осадок образуется до тех пор, пока
– раствор насыщен, осадок образуется до тех пор, пока 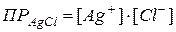 .
.
б) газообразных (легколетучих) веществ:
например, 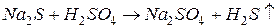
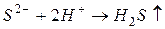
Если эту реакцию проводить до конца в открытом сосуде, то 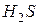 удаляется из сферы реакции, т. е. не может участвовать в обратном процессе, и данная реакция идет практически до конца.
удаляется из сферы реакции, т. е. не может участвовать в обратном процессе, и данная реакция идет практически до конца.
в) слабых электролитов (малодиссоциирующих соединений):
например, § образование воды: 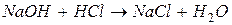
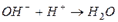
§ образование слабого основания: 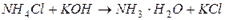
§ образование слабой кислоты: 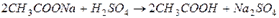
При образовании малодиссоциирующих соединений происходит связывание ионов реагирующих веществ, и растворы становятся слабыми проводниками электрического тока.
г) комплексных ионов: 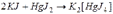
61. Гидролиз солей.: определение, случаи гидролиза, ступенчатый гидролиз.
Гидролиз – это химическая реакция, происходящая при взаимодействии какого-либо вещества (неорганические соли, белки, аминокислоты, углеводы и др. вещества органической природы) с водой.
Если соль образована слабой многоосновной кислотой или слабым многокислотным основанием, то гидролиз данной соли может протекать ступенчато. Число ступеней гидролиза зависит от основности слабой кислоты и кислотности слабого основания.
Рассмотрим гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В водном растворе этих солей на первой ступени гидролиза образуется кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуются соли K2SiO3, Na2SO3, Na2S, Na3PO4 и др.
Размещено на реф. рф
Например, гидролиз Na2CO3 должна быть изображен в виде уравнений.
|
|
|
Первая ступень˸ Na2CO3 + Н2О ↔ NaHCO3 + NaOH;
CO32- + H2O ↔ НCO-3 + OH-.
Продуктами первой ступени гидролиза является кислая соль гидрокарбонат натрия NaHCO3 и гидроксид натрия NaOH.
Вторая ступень˸ NaHCO3 + Н2О ↔ Н2СО3 + NaOH;
HCO-3 + Н2О ↔ Н2СО3 + ОН-.
Продуктами второй ступени гидролиза карбоната натрия Na2CO3 являются гидроксид натрия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени. Среда раствора соли карбоната натрия Na2CO3 - щелочная (рН > 7), так как в растворе увеличивается концентрация гидроксид-ионов ОН-.
Гидролиз солей трехосновных слабых кислот протекает по трем ступеням. В качестве примера приведем уравнения гидролиза фосфата натрия.
Первая ступень˸ Na3РО4 + Н2О ↔ Na2НРО4 + NaOH;
РО43- + Н2О ↔ НРО42- + NaOH.
Вторая ступень˸ Na2НРО4 + Н2О ↔ NaH2PO4 + NaOH;
НРО42- + Н2О ↔ H2PO-4 + ОН-.
Третья ступень˸ NaH2PO4 + Н2О ↔ Н3РО4 + NaOH;
Н2РО-4 + Н2О ↔ Н3РО4 + ОН-.
Гидролиз по первой ступени происходит в значительно большей степени, чем по второй. По третьей ступени гидролиз фосфата натрия практически не идет.
Рассмотрим гидролиз соли, образованной слабым многокислотным основанием и сильной кислотой. В водных растворах таких солей на первой ступени образуется основная соль вместо основания и сильная кислота. Ступенчатому гидролизу подвергаются соли˸ MgSO4, FeCl3, FeCl2, ZnCl2 и др.
Размещено на реф. рф
Например, гидролиз хлорида цинка ZnCl2 протекает по двум ступеням.
Первая ступень˸ ZnCl2+ H2О ↔ ZnOHCl + HC1;
Zn2+ + Н2О ↔ (ZnOH)+ + Н+.
Вторая ступень˸ ZnOHCl+ H2O ↔ Zn(OH) 2 + HC1;
(ZnOH)+ + Н2О ↔ Zn(OH)2 + H+.
Гидролиз соли идет по катиону, так как соль образована слабым основанием Zn(OH)2 и сильной кислотой НСl. Катионы цинка Zn2+ связывают гидроксид-ионы ОН- воды. На первой ступени образуется основная соль ZnOHCl и сильная кислота НСl. На второй ступени образуется слабое основание Zn(OH)2 и тоже сильная хлороводородная кислота. Гидролиз по первой ступени протекает значительно больше, чем по второй. В растворе увеличивается концентрация ионов водорода Н+ и реакция среды будет кислая (рН < 7).
|
|
|
гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу не подвергаются. Таким образом, возможность протекания гидролиза соли определяется наличием иона от слабого электролита (от кислоты или от основания, реакцией между которыми могла быть образована данная соль).
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительно и преимущественно по первой ступени (один моль ион слабого электролита взаимодействует только с одним молем молекул воды).
Реакцию среды при гидролизе можно определить по иону сильного электролита. Если соль образована катионом сильного основания и анионом слабой кислоты(S2-, CO32-, CN-и др. ), то происходит гидролиз по аниону, а среда будет щелочной.
Процесс гидролиза протекает тем интенсивнее, чем слабее электролит, образовавший соль в процессе реакции нейтрализации. Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону, а среда будет кислотной.
Гидролиз солей, образованных слабым основанием и слабой кислотой, протекает достаточно глубоко (практически полностью).
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей практически нейтральную реакцию среды.
|
|
|


