 |
Введение в химию коллоидных систем
|
|
|
|
3.2.1. Классификация коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
В случае если одно вещество распределено в другом в виде молекул или ионов, то такую систему называют раствором (гомогенная система). В случае же, если частицы вещества имеют более крупный размер, система считается дисперсной (гетерогенная система). Дисперсные системы - это системы, где одно вещество в виде частиц различной величины распределено в другом. При этом сплошная фаза дисперсной системы называется дисперсионной средой, а диспергированное вещество - дисперсной фазой.Условие получения дисперсных систем -взаимная нерастворимость диспергируемого вещества и дисперсионной среды.
Различают три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
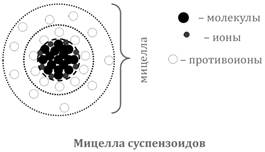
Суспензоиды (необратимые коллоиды, лиофобные коллоиды) - это растворы металлов, их соединений (оксидов, солей).Структура частиц дисперсной фазы суспензоидов не отличается от структуры соответствующего компактного вещества и имеет молекулярную или ионную кристаллическую решетку. Единица структуры - мицелла
Необратимые - при выпаривании их растворов осадок нельзя вновь перевести в золь при растворении.
Лиофобные(от греч. лиос-жидкость, фобо- страх) - Характерно слабое взаимодействие между дисперсной фазой и дисперсионной средой.
Мицелла суспензоидов- сложный многокомпонентный агрегат переменного состава, состоящий из десятков, сотен и более молекул.
Мицеллярные (ассоциативные) коллоиды – эторастворы, в которых коллоидные частицы возникают при агрегации (слипании) дифильных молекул, т. е. молекул, содержащих полярные группы и неполярные углеводородные радикалы: R - OH; R - COOH; R - COONa. R- гидрофобная COOH -гидрофильная
|
|
|
Дифильное строение - одна часть молекулы гидрофильная, другая гидрофобная.
В основном, это соли щелочных металлов высших жирных кислот (мыла), например, C17H35COONa

Молекулярные коллоиды (обратимые, лиофильные) - это растворы природных или синтетических высокомолекулярных веществ (ВМС).
Лиофильные (от греч. лиос-жидкость, фило - лю блю) - сильное взаимодействие частиц дисперсной фазы с дисперсионной средой
Размер одной макромолекулы меняется от 10-8 м и более Единица структуры -одна макромолекула

3.2.2Способы получения коллоидных систем (дисперсионные, конденсационные). Стабилизация суспензоидов.
| Методы получения коллоидов | ||
| Суспензоиды | Молекулярные и мицеллярные коллоиды | |
| Дисперсионные | Конденсационные | Растворение |
| Измельчение крупных частиц дисперсной фазы | Получениенерастворимыхсоединений | Мыловводе |
| Дробления в коллоидных мельницах, помол, истирание. | Реакции в разбавленных растворах: обмена, гидролиза, ОВР |
ПРИМЕРЫ ПОЛУЧЕНИЯ СУСПЕНЗОИДОВ
а) Ионный обмен: AgNO3 + KCl = AgCl (коллоид) + KNO3
AgCl нерастворим в воде, раствор разбавленный, его размер останется на уровне коллоидных частиц, т. е. осадок не выпадет.
б) Гидролиз:Al2(SO4)3 + 6H2O = 2Al(OH)3(Коллоид)+ 3H2SO4
в) метод замены растворителя
если к водному раствору хлорида натрия прилить спирт, в котором NaCl нерастворим, то можно получить коллоидный раствор.
Стабилизация суспензоидов
Стабилизаторы - вещества, препятствующих процессу самопроизвольного укрупнения (коагуляции) коллоидных частиц.
Устойчивые коллоидные растворы содержат не менее трех компонентов: дисперсную фазу, дисперсионную среду; стабилизатор.
В качестве стабилизаторов используют электролиты и молекулы высокомолекулярных веществ (белки, поливиниловый спирт)

| |
| Электролиты Ионы создают пограничные слои между дисперсионной фазой и дисперсионной средой. | Высокомолекулярные вещества адсорбируются на поверхности частицы и создает структурно-механический барьер, препятствующий укрупнению. |
3.2.3Свойства коллоидных систем. Оптические свойства: опалесценция, эффект Тиндаля.
|
|
|
|
|
|


