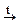|
Проба бейльштейна на галоиды.
|
|
|
|
Петлю из тонкой медной проволоки прокалывают на пламени спиртовки до прекращения окрашивания пламени. Остывшей почерневшей проволокой набирают немного исследуемого вещества и вводят в пламя. В присутствии галоидов появляется зеленое окрашивание пламени летучих галогенидов меди(I).
Напишите схему реакции. Укажите аналитический признак.
| RHal + CuO | |
Лабораторная работа № 3
«Предельные и непредельные углеводороды»
3.1. БРОМИРОВАНИЕ предельных УГЛЕВОДОРОДОВ
Материалы: гексан, 1% раствора брома в ССl4., индикаторная бумага.
Работу проводить в вытяжном шкафу.
К 5 каплям гексана в сухой пробирке при легком встряхивании добавляют 5 капель раствора брома. Если желтая окраска не исчезает при комнатной температуре, то смесь слегка нагревают. Наличие или отсутствие выделения бромоводорода устанавливают внесением в пробирку полоски влажной индикаторной бумаги.
а) Напишите два основных продукта реакции бромирования гексана.
Назовите эти соединения.

| |
|
| |
| + | |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AR; 2) SR; 3) AE; 4) SE; 5) AN; 6) SN |
3.2. ОБРАЗОВАНИЕ И СВОЙСТВА АЛКЕНОВ
Материалы: изопропиловый спирт, конц. серная кислота, бромная вода, 5% раствор KMnO4.
Работу проводить в вытяжном шкафу.
В пробирку помещают 4 капли спирта и осторожно, при встряхивании, приливают 8 капель серной кислоты, опускают «кипелку» (вместо кипелки можно использовать несколько крупинок Al2O3 или SiO2). Пробирку закрывают пробкой с газоотводной трубкой и осторожно нагревают до начала выделения газа.
а) Напишите схему реакции дегидратации спирта. Назовите полученное
|
|
|
соединение.
|
| |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) Е1; 4) SR; 5) AN; 6) SN |
| в) Какую роль выполняют кипелки или оксиды алюминия (Al2O3) и кремния (SiO2)? | 1) катализируют реакцию; 2) нейтрализуют кислоту; 3) являются центрами кипения; 4) отщепляют воду. |
Газоотводную трубку последовательно помещают в две пробирки, содержащие, соответственно, 4 капли бромной воды и 1 каплю 5% раствора KMnO4 и 5 капель воды. Наблюдают изменение окраски растворов в этих пробирках.
г) Напишите схемы реакций полученного алкена с растворами брома и KMnO4, назовите полученные соединения.

| |
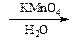
| |
При поджигании выходящего из трубки газа наблюдают цвет пламени. На внесенной в пламя фарфоровой пластинке появляется сажа.
д) Напишите схему реакции горения данного углеводорода.

|
3.3. ОБРАЗОВАНИЕ И СВОЙСТВА АЦЕТИЛЕНА
Материалы: карбид кальция, бромная вода, 5% раствор KMnO4, аммиачный раствор хлорида меди(I), 1% раствор фенолфталеина.
Работу проводить в вытяжном шкафу.
В пробирку с газоотводной трубкой помещают маленький кусочек карбида кальция и 2-3 капли воды.
а) Напишите схему реакции получения ацетилена.

|
С выделяющимся ацетиленом проводят следующие опыты.
Непредельный характер газа доказывают обесцвечиванием бромной воды и раствора KMnO4.
б) Напишите схемы реакций полученного ацетилена с растворами брома и KMnO4, назовите полученные соединения.
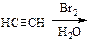
| 
| ||

| |
Под конец реакции введите в отверстие пробирки полоску фильтровальной бумаги (5х40 мм), смоченной бесцветным аммиачным раствором хлорида меди(I). Появляется красновато-коричневое окрашивание вследствие образования ацетиленида меди(I).
|
|
|
в) Напишите схему реакции ацетилена с аммиачным раствором хлорида
меди(I).

|
При поджигании, выходящего из трубки газа, наблюдают цвет пламени. На внесенной в пламя фарфоровой пластинке появляется сажа.
г) Укажите цвет пламени. Напишите схему реакции горения ацетилена.
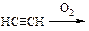
|
По окончании выделения ацетилена в пробирку добавьте 1 каплю раствора фенолфталеина. Наблюдают изменение окраски.
д) Укажите цвет окраски. О чем свидетельствует изменение окраски раствора при добавлении фенолфталеина?
Лабораторная работа № 4
«Ароматические углеводороды»
4.1. БРОМИРОВАНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ БЕЗ
КАТАЛИЗАТОРА
Материалы: бензол, нафталин, 1% раствор брома в CСl4, индикаторная бумага.
Работу проводить в вытяжном шкафу.
Готовят две пробирки с 5 каплями бензола и две пробирки с небольшим количеством нафталина (один шпателек). Добавляют в каждую 5 капель раствора брома и встряхивают. После чего, одну из пробирок с ароматическим углеводородом оставляют стоять при комнатной температуре, а другую – нагревают до кипения. Отмечают, в каких пробирках произошло обесцвечивание раствора брома и выделение бромоводорода, которое можно установить внесением полоски влажной индикаторной бумаги в пробирку.
| а) Напишите, какое соединение подвергается бромированию. |
| б) В каких условиях реакция идет быстрее? | 1) при комнатной температуре; 2) при нагревании. |
в) Напишите схему реакции бромирования. Назовите полученное соединение.

| |
| г) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
4.2. БРОМИРОВАНИЕ толуола
Материалы: толуол, 1% раствор брома в CСl4, индикаторная бумага, железные опилки.
Работу проводить в вытяжном шкафу.
В две пробирки вносят по 5 капель толуола и добавляют по 2-3 капли 1% раствора брома в ССl4. Во вторую пробирку дополнительно вносят на кончике шпателя железные опилки. Пробирки нагревают на кипящей водяной бане до обесцвечивания брома. Выделение бромоводорода устанавливают внесением полоски влажной индикаторной бумаги в пробирку.
|
|
|
а) Напишите схему реакции монобромирования толуола без катализатора. Назовите полученное соединение.

| |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
в) Напишите схему реакции монобромирования толуола в присутствии катализатора. Назовите полученные соединения.

| |
| г) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
| д) Какую роль играет железо в этой реакции? | 1) образует FeBr3; 2) FeBr3 поляризует молекулу Br2; 3) связывает HBr; 4) служит центром кипения. |
4.3. БРОМИРОВАНИЕ СТИРОЛА
Материалы: стирол, 3-5% раствор брома в уксусной кислоте.
Работу проводить в вытяжном шкафу.
К 5-6 каплям стирола в пробирке добавляют при встряхивании по каплям раствор брома до прекращения его обесцвечивания. Смесь разбавляют двойным объемом холодной воды и через 5-10 мин наблюдают образование белого осадка.
а) Напишите схему реакции бромирования стирола. Назовите полученное
соединение.
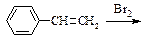
| |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
4.4. окисляемость АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Материалы: бензол, толуол, 5% раствор KMnO4, 10% раствор серной кислоты.
Работу проводить в вытяжном шкафу.
Опыт проводится одновременно с бензолом и толуолом. В пробирку с 5 каплями воды добавляют 1 каплю 5% раствор KMnO4 и 1 каплю 10% раствора серной кислоты. Затем вносят в одну пробирку 1 каплю толуола, а в другую – 1 каплю бензола. Сильно встряхивают пробирки несколько минут, наблюдая изменение окраски в одной из пробирок. Пробирку, где не произошло обесцвечивание, нагревают над пламенем горелки и наблюдают, изменяется ли окраска.
| а) Напишите, какое соединение окислилось в данных условиях. |
б) Напишите схему реакции окисления арена. Назовите полученное соединение.
|
|
|

| |
4.5. окислЕНИЕ НАФТАЛИНА
Материалы: нафталин, 40% раствор гидроксида натрия, 5% раствор KMnO4.
Работу проводить в вытяжном шкафу.
В пробирку вносят на кончике шпателя нафталин, 1 каплю 5% раствора KMnO4 с 5 каплями воды и 1-2 капли 40% раствора гидроксида натрия. Закрывают пробирку пробкой с прямой газоотводной трубкой и нагревают в пламени спиртовки. После чего продолжают нагревание в кипящей водяной бане. Наблюдают исчезновение окраски и появление темного осадка.
Напишите схему реакции окисления арена. Назовите полученное соединение.

| |
4.6. НИТРОВАНИЕ НАФТАЛИНА
Материалы: нафталин, конц. азотная кислота.
Работу проводить в вытяжном шкафу.
К 10 каплям конц. азотной кислоты добавляют на кончике шпателя нафталин. Смесь нагревают 5 мин на кипящей водяной бане при частом встряхивании и затем выливают 10 капель холодной воды. Продукт реакции выделяется в виде оранжевого масла, быстро твердеющего при охлаждении.
а) Напишите схему реакции нитрования нафталина. Назовите полученное соединение.

| |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
Лабораторная работа № 5
«Галогенпроизводные углеводородов»
5.1. ПОЛУЧЕНИЕ ЭТИЛХЛОРИДА
Материалы: этанол, хлорид натрия, конц. серная кислота.
Работу проводить в вытяжном шкафу.
В пробирку помещают 2-3 шпателька растертого хлорида натрия. Добавляют 3-4 капли этанола, так чтобы вся соль была смочена спиртом. Затем вносят 3-4 капли конц. серной кислоты и нагревают на слабом пламени спиртовки, не допуская обильного выделения хлороводорода. Время от времени подносят отверстие пробирки к пламени спиртовки. Выделяющийся этилхлорид загорается, образуя колечко зеленого цвета, что характерно для низших галогеналкилов. Так как реакция протекает довольно медленно, то образование этилхлорида начинается не сразу.
а) Напишите схему реакции замещения спирта.
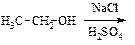
|
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
5.2. ОБНАРУЖЕНИЕ ХЛОР- И БРОМПРОИЗВОДНЫХ
Материалы: галогенсодержащее соединение (бутилбромид), 15% раствор NаI в ацетоне.
К 10 каплям раствора иодида натрия прибавляют 2 капли исследуемого вещества и выдерживают 3 мин при комнатной температуре, иногда (особенно для хлоридов) необходимо выдержать еще 5 мин при 50 °C. Помутнение раствора свидетельствует о наличие в соединениях хлора или брома.
|
|
|
а) Напишите схему реакции. Назовите полученное соединение.

| |
| б) Укажите, по какому механизму протекает эта реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
5.3. ОТЩЕПЛЕНИЕ ГАЛОИДА ПО МЕТОДУ СТЕПАНОВА
Материалы: галогенсодержащий углеводород (бутилбромид), этанол, натрий, 1% раствор AgNO3, 10% раствор азотной кислоты, индикаторная бумага.
Работу с натрием проводить в вытяжном шкафу.
3-4 капли галогенпроизводного растворяют в 10 каплях спирта и добавляют кусочек натрия размером со спичечную головку. Смесь начинает кипеть, мутнеет. По окончании выделения водорода и полного растворения натрия пробирку охлаждают, разбавляют двойным объемом дистиллированной воды и доводят смесь до кислой реакции 10% раствором азотной кислоты по каплям (индикаторная бумага). Прибавление нескольких капель раствора нитрата серебра вызывает выпадение осадка галоидного серебра.
Напишите схемы протекающих реакций. Назовите полученные соединения.

|
| |

|
| |
|
| ||
|
| + | |
|
| ||
5.4. ГИДРОЛИЗ ХЛОРОФОРМА
Материалы: хлороформ, 1% раствор AgNO3, 10% раствор гидроксида натрия, 10% раствор азотной кислоты, 25% раствор аммиака, 5% раствор KMnO4.
Помещают в пробирку 5-7 капель хлороформа и 1-2 мл 10%. раствора щелочи, осторожно нагревают 1-2 мин при частом встряхивании.
а) Напишите схему реакции. Назовите полученное соединение.

| |
Охлажденный гидролизат делят на три части.
В первую пробирку добавляют разб. азотную кислоту до кислой среды и несколько капель раствора нитрата серебра. Наблюдают помутнение.
б) Напишите схему реакции. Назовите полученное соединение.
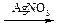
| |
Вторую порцию приливают в пробирку, в которой 5 капель раствора нитрата серебра добавлением конц. раствора аммиака (по каплям до растворения первоначально образующегося осадка) перевели в аммиачный раствор гидроксида серебра, и осторожно нагревают на водяной бане.
в) Напишите схему реакции. Назовите полученное соединение.

| |
К третьей части добавляют 1 каплю 5% раствора KMnO4 в 5 каплях воды и наблюдают протекание реакции окисления.
г) Напишите схему реакции. Назовите полученное соединение.
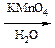
| |
5.5. РАЗЛИЧИЕ В СВОЙСТВАХ ГАЛОГЕНОВ В ЯДРЕ И В БОКОВОЙ ЦЕПИ.
Материалы: хлорбензол, бензилхлорид, 5% раствор AgNO3.
В одну пробирку вносят 1 каплю хлорбензола, во вторую – 1 каплю бензилхлорида и добавляют в каждую из них по 5 капель воды. Нагревают пробирки до кипения и добавляют в каждую по 1 капле 5% раствора AgNO3. Наблюдают появление белого осадка в одной из пробирок.
| а) Напишите, какое соединение гидролизовалось в данных условиях. |
б) Напишите схемы протекающих реакций.
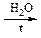
| |
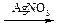
|
| в) Укажите, по какому механизму протекает реакция гидролиза. | 1) AЕ; 2) SЕ; 3) AN; 4) SN; 5) АR; 6) SR |
Лабораторная работа № 6
«Спирты и фенолы»
6.1. йОДОФОРМНАЯ РЕАКЦИЯ
Материалы: этанол, раствор йода в иодиде калия, 10% раствор гидроксида натрия.
В пробирке смешивают 5-7 капель этанола, 3-4 капли раствора йода в иодиде калия и столько же раствора щелочи. Смесь чуть подогревают (можно даже рукой), появляется желтоватая взвесь со стойким характерным запахом йодоформа. Если взвесь исчезает, добавляют к еще теплому раствору 2-3 капли раствора йода. Через несколько минут при охлаждении выпадают желтые кристаллы.
а) Напишите схемы реакций. Назовите полученные соединения.
|
| ||
|
| ||

|
| |
|
| ||

|
| |
|
| ||
| б) Укажите общую структурную формулу спиртов, вступающих в эту реакцию. |
6. 2. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ГЛИКОЛИ
Материалы: многоатомный спирт (этиленгликоль), 3% раствор сульфата меди(II), 10% раствор гидроксида натрия.
В пробирку наливают 3 капли раствора сульфата меди и 3 капли раствора щелочи. К смеси быстро добавляют 1-2 капли этиленгликоля. Голубой осадок гидроксида меди растворяется и осадок принимает интенсивную синюю окраску.
а) Напишите схемы реакций.

|

|

|
|
|
|