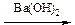|
Качественная реакция на фенолы
|
|
|
|
Материалы: 1% растворы фенолов (фенол, пирокатехин, резорцин, пирогаллол, 1-нафтол), 1% свежий раствор FeCl3.
В пробирки, содержащие по 3 капли растворов различных фенолов, добавляют по 1-2 капли раствора FeCl3. Образуются окрашенные растворы.
а) Напишите упрощенную схему реакции фенола с FeCl3, укажите цвет комплекса

| |
б) Заполните таблицу.
| Название соединения | Структурная формула | Цвет комплекса с FeCl3 |
| пирокатехин | ||
| резорцин | ||
| пирогаллол | ||
| 1-нафтол |
6. 4. ОБРАЗОВАНИЕ И ГИДРОЛИЗ АЛКОГОЛЯТА
Материалы: этанол, натрий, 1% раствор фенолфталеина.
Работу проводить в вытяжном шкафу.
В сухую пробирку помещают 3 капли этанола и добавляют небольшой кусочек очищенного натрия до полного растворения (осторожно!). Пробирку закрывают пробкой с газоотводной трубкой и поджигают выделяющийся газ. Когда жидкость загустеет и реакция замедлится, пробирку слегка подогревают. При охлаждении продукт закристаллизовывается.
а) Напишите схему реакции. Назовите полученное соединение.

| |
В пробирку добавляют 2-3 капли воды (не должно остаться свободного натрия!) и определяют раствором фенолфталеина среду.
б) Напишите схему реакции.

|
| в) О чем свидетельствует изменение окраски раствора при добавлении фенолфталеина? |
6. 5. ОБРАЗОВАНИЕ И ГИДРОЛИЗ ФЕНОЛЯТОВ
Материалы: фенол, 10% раствор гидроксида натрия, 10% раствор серной кислоты, 5% растворы гидрокарбоната и карбоната натрия.
Работу проводить в вытяжном шкафу.
А. К нескольким кристаллам фенола (осторожно!) добавляют 5-7 капель воды, а затем разб. раствор щелочи до полного растворения.
|
|
|
а) Напишите схему реакции. Назовите полученное соединение.

| |
При подкислении по каплям раствора разб. серной кислотой осадок выделяется снова.
б) Напишите схему реакции.

|
Б. В две пробирки помещают несколько кристаллов фенола. В одну добавляют 5-7 капель водного раствора карбоната натрия, а во вторую – такое же количество раствора гидрокарбоната натрия. Полное растворение наблюдается в первом случае.
в) Напишите схему реакции.

|
г) Объясните причину отсутствия реакции с гидрокарбонатом натрия.

|
6. 6. ОКИСЛЕНИЕ ИЗОПЕНТИЛОВОГО (ИЗОАМИЛОВОГО) СПИРТА
Материалы: изоамиловый спирт, 5% раствор бихромат калия, конц. серная кислота.
К смеси 1 капли конц. серной кислоты и 3 капель спирта добавляют 2 капли 5% раствора бихромата калия, и после встряхивания добавляют 5 капель воды. Полученный оранжевый раствор нагревают над пламенем горелки до начала изменения цвета. Появляется сладковатый запах альдегида, который при дальнейшем нагревании сменяется неприятным запахом соответствующей кислоты.
Напишите схемы реакций. Назовите полученные соединения.
|
| ||
|
| ||

|
| |
|
| ||
6. 7. ОКИСЛЕНИЕ ФЕНОЛОВ
Материалы: растворы фенола и 1-нафтола, 5% раствор КMnO4.
К 3-5 каплям водного раствора фенола и нафтола добавляют равный объем раствора карбоната натрия и по каплям при встряхивании раствор перманганата калия. Наблюдается обесцвечивание раствора и выделение MnO2.
Напишите схемы реакций. Назовите полученные соединения.

| |

| |
6. 8. БРОМИРОВАНИЕ ФЕНОЛА
Материалы: фенол, бромная вода, бензол, 5% раствор иодида калия.
|
|
|
Работу проводить в вытяжном шкафу.
В пробирку помещают несколько кристаллов фенола (шпателек) и 5-7 капель воды, затем добавляют по каплям бромную воду. Выделяется объемный белый осадок.
а) Напишите схему реакции. Назовите полученное соединение.

| |
| б) Укажите, по какому механизму протекает реакция. | 1) AЕ; 2) SЕ; 3) AN; 4) SN1; 5) SN2; 6) АR; 7) SR |
При дальнейшем добавлении бромной воды, при встряхивании, белый осадок превращается в светло-желтый. Смесь нагревают и кипятят 1-2 мин для удаления избытка брома. При охлаждении осадок выпадает снова.
в) Напишите схему реакции. Назовите полученное соединение.

| |
Лабораторная работа № 7
«Альдегиды и кетоны»
7.1. РЕАКЦИЯ ТРОММЕРА НА АЛЬДЕГИДЫ
Материалы: альдегид (40% формалин), 2% раствор сульфата меди(II), 1% раствор гидроксида натрия.
Поместите в пробирку 6 капель 1% раствора гидроксида натрия, разбавьте его 6 каплями воды и добавьте 1 каплю 2% раствора CuSO4.
а) Напишите схему реакции.

|
К выпавшему синему осадку прибавьте 2-3 капли исследуемого альдегида и взболтайте раствор. Нагрейте до кипения (кипятить нет необходимости) над пламенем спиртовки. В пробирке выпадет осадок, вначале желтый, затем красный, и, если пробирка чистая, может выделиться на стенках пробирки «медное зеркало» – слой металлической меди.
б) Напишите схему реакции. Назовите полученное соединение.

|
| |
|
| ||
в) Что представляет собой.
| 1. желтый осадок; | 2. красный осадок? |
7.2. РЕАКЦИЯ ТОЛЛЕНСА НА АЛЬДЕГИДЫ
Материалы: альдегиды (1% формалин), 2% раствор аммиака, 1% раствор AgNO3, 10% раствор гидроксида натрия.
Поместите в чистую пробирку по 1 капле 1% раствора AgNO3 и 10% раствор гидроксида натрия. В пробирке выпадает бурый осадок. К выпавшему осадку при встряхивании добавляют по каплям 2% раствор аммиака до полного растворения осадка.
а) Напишите схемы реакций.

|

|
К полученному раствору добавляют 2 капли альдегида и наблюдают выпадение темного осадка, который при легком нагревании дает зеркальный налет.
|
|
|
б) Напишите схему реакции. Назовите полученное соединение.

|
| |
|
| ||
7.3. ПОЛУЧЕНИЕ УРОТРОПИНА
Материалы: 40% формалин, конц. раствор аммиака.
Работу проводить в вытяжном шкафу.
Поместите в пробирку 1 каплю 10% раствора фенолфталеина и 2 капли раствора аммиака. Жидкость принимает ярко-розовый цвет. Прибавьте к ней 1 каплю 40%-ного формалина. Через несколько секунд жидкость обесцвечивается. Добавьте вновь 2 капли раствора аммиака – жидкость покраснеет, но снова быстро обесцветиться. Добавляйте по каплям раствор аммиака до тех пор, пока не получится неисчезающее розовое окрашивание, указывающее на то, что весь формальдегтд уже связан аммиаком и в полученном растворе уротропина имеется даже небольшой избыток аммиака. Налейте несколько капель раствора на предметное стекло и осторожно выпаривайте раствор над пламенем горелки. Для ускорения удаления воды помешивайте раствор стеклянной палочкой. После упаривания воды на стекле остаются кристаллы уротропина.
Напишите схему реакции.

|
7. 4. БРОМИРОВАНИЕ АЦЕТОНА
Материалы: ацетон, 1% раствор брома в CCl4, индикаторная бумага.
Работу проводить в вытяжном шкафу.
К 5 каплям раствора брома в сухой пробирке добавьте 1 каплю ацетона, осторожно подогрейте. Наблюдают обесцвечивание раствора и выделение бромоводорода (полоска влажной индикаторной бумаги). Полоску фильтровальной бумаги смачивают раствором, дают растворителю испариться, после чего обнаруживают характерный запах бромацетона.
Напишите схему реакции.

|
7.5. ЙОДОФОРМНАЯ РЕАКЦИЯ
Материалы: ацетон, 10% раствор гидроксида натрия, раствор йода в иодиде калия.
Работу проводить в вытяжном шкафу.
Поместите в пробирку 1 каплю раствора йода в растворе иодида калия и добавьте по каплям почти до обесцвечивания 10% раствор гидроксида натрия. К полученному раствору добавьте 1 каплю ацетона. Наблюдают выпадение желтовато-белого осадка с характерным запахом йодоформа.
|
|
|
а) Напишите схемы реакций. Назовите полученные соединения.

| |

| |
| б) Укажите общую структурную формулу карбонильных соединений, вступающих в эту реакцию. |
Лабораторная работа № 8
«Карбоновые кислоты и их производные»
8.1. СРАВНЕНИЕ СТЕПЕНИ КИСЛОТНОСТИ КАРБОНОВІХ КИСЛОТ
Материалы: растворы органических кислот (муравьиная, уксусная, щавелевая, бензойная), раствор фенола, 3% соляная кислота, индикаторная бумага.
По полоске сухой индикаторной бумаги проводят поперек спичкой или стеклянной палочкой, смоченной соответствующим раствором кислоты. Сравнивают степень ионизации кислот между собой и с раствором фенола и 3% соляной кислотой.
Заполните таблицу.
| Название соединения | Структурная формула | pH |
| муравьиная кислота | ||
| уксусная кислота | ||
| щавелевая кислота | ||
| бензойная кислота | ||
| фенол | ||
| соляная кислота |
8.2. ЭТЕРИФИКАЦИЯ УКСУСНОЙ КИСЛОТЫ
Материалы: уксусная кислота, изопентиловый (изоамиловый) спирт, конц. серная кислота.
Смешайте в пробирке 5 капель уксусной кислоты, 8 капель изопентилового спирта и 4 капли конц. серной кислоты. Смесь нагрейте (5-10 минут) на кипящей водяной бане и вылейте в пробирку с 2-3 мл воды. Всплывший слой эфира имеет характерный грушевый запах.
а) Напишите схему реакции. Назовите полученное соединение.

| |
| б) Какова роль серной кислоты в этом процессе? | 1) водоотнимающее средство; 2) ускоряет установление равновесия; 3) смещает равновесие в сторону эфира. |
8.3. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ.
Материалы: этилацетат, 10% раствор серной кислоты, 40% раствор гидроксида натрия.
В три пробирки наливают по 10 капель воды, добавляют 5-7 капель этилацетата. Во вторую пробирку дополнительно вносят 2 капли 10% серной кислоты, а в третью – 2 капли 40% раствора щелочи. Все пробирки нагревают при встряхивании в горячей (60-70 °С) воде. Наблюдают различие в скорости исчезновения капель сложного эфира и его запаха во всех трех пробирках.
а) Отметьте, в каких условиях гидролиз протекал:
| 1. быстрее всего; | |
| 2. со средней скоростью; | |
| 3. наиболее медленно |
б) Напишите схемы реакций. Назовите полученные соединения.

| |

| |
8.4. ГИДРОЛИЗ АСПИРИНА
Материалы: аспирин, 1% раствор FeCl3.
Поместите в две пробирки несколько кристалликов аспирина и 5-6 капель воды. Встряхните пробирки, чтобы ускорить растворение вещества. Затем одну из них кипятят 2-3 мин, охлаждают и добавляют в каждую пробирку 1-2 капли 1% раствора FeCl3. Наблюдают различие в окрашивании.
|
|
|
а) Напишите схему реакции. Назовите полученные соединения.

| |
| в) Реакция с раствором FeCl3 подтверждает наличие: | 1) ароматического цикла; 2) карбоксильной группы; 3) фенольного гидроксила. |
8.5. ОКИСЛЕНИЕ муравьиной и щавелевой КИСЛОТ
Материалы: муравьиная и щавелевая кислота, 10% серная кислота, 5% раствор КMnO4, раствор гидроксида бария.
Поместите в пробирку 5 капель муравьиной кислоты. Затем в пробирку добавьте 3-5 капель 10% раствора серной кислоты и 2 капли 5% раствора перманганата калия. Пробирку закрывают пробкой с газоотводной трубкой, конец которой помещают во вторую пробирку с 5 каплями баритовой воды. При нагревании первой пробирки наблюдается обесцвечивание реакционной смеси и выпадение осадка во второй пробирке.
а) Напишите схемы реакций.
|
| ||
|
| ||
Повторите эксперимент с пробиркой, в которую помещен шпателек щавелевой кислоты.
б) Напишите схемы реакций.
|
| ||
|
| ||
8.6. ОКИСЛЕНИЕ НЕПРЕДЕЛЬНЫХ КАРБОНОВЫХ КИСЛОТ ПО РЕАКЦИИ ВАГНЕРА
Материалы: малеиновая кислота, 5% раствор KMnO4.
В пробирке растворяют шпателек малеиновой кислоты в 5-10 каплях воды, добавляют по каплям, при встряхивании, раствор KMnO4 (1 капля 5% раствор KMnO4 и 5 капель воды) до прекращения обесцвечивания. Отмечают выпадение бурого осадка оксида марганца.
Напишите схему реакции. Назовите полученное соединение.

| |
8.7. БРОМИРОВАНИЕ НЕПРЕДЕЛЬНЫХ КИСЛОТ
Материалы: коричная кислота, бромная вода.
Работу проводить в вытяжном шкафу.
В пробирке растворите шпателек коричной кислоты в 10-15 каплях воды, прибавьте 2-4 капли бромной воды и нагрейте до кипения. При охлаждении возможно выпадение осадка.
Напишите схему реакции. Назовите полученное соединение.

| |
|
|
|