 |
Условные термины растворимости
|
|
|
|
| Условный термин | Количество растворителя, мл, необходимое для растворения 1,0 г вещества |
| Очень легко растворим | Не более 1 |
| Легко растворим | От 1 до 10 |
| Растворим | >> 10 >> 30 |
| Умеренно растворим | >> 30 >> 100 |
| Мало растворим | >> 100 >> 1000 |
| Очень мало растворим | >> 1000 >> 10000 |
| Практически нерастворим | Более 10000 |
Растворимость – важный показатель качества препарата, поэтому нужно уметь прогнозировать возможные изменения этого показателя в зависимости от условий хранения.
Испытания лекарственных средств на чистоту
и допустимые пределы примесей
Основным принципом в требованиях к чистоте лекарственных средств является отсутствие или ограниченное содержание тех примесей, которые могут отрицательно влиять на их физико-химические и фармакологические свойства.
Все лекарственные вещества содержат небольшое количество примесей.
Во-первых, примеси могут попасть в субстанцию в процессе ее получения. Причины появления примесей: недостаточная очистка исходных веществ синтеза; загрязнение вспомогательными веществами и реактивами, а также продуктами побочных реакций, промежуточными продуктами синтеза; попадание примесей из металлической аппаратуры (свинец, цинк, медь, железо, мышьяк и др.). При выделении биологически активных соединений (алкалоиды, витамины, гормоны) из природных источников в качестве примесей могут присутствовать другие соединения, содержащиеся в сырье.
Следует отметить, что все лекарственные вещества при их получении подвергаются очистке. Однако, полностью удалить все примеси нельзя, так как существует технологический предел возможности очистки. Кроме того, применение «химически чистых» веществ в качестве лекарственных средств экономически не выгодно, так как это значительно повышает стоимость лекарств.
|
|
|
Во-вторых, примеси могут образоваться при неправильном хранении лекарственного средства (под действием света, повышенной (или пониженной) температуры, кислорода, диоксида углерода, влаги воздуха и др.).
В зависимости от характера примесей их подразделяют на:
а) примеси, влияющие на фармакологическое действие препаратов;
б) примеси, не имеющие специфического действия, а указывающие на степень очистки вещества, например, хлориды, сульфаты в органических соединениях. Присутствуя в больших количествах, последние могут уменьшить активность лекарства, поэтому необходимо также устанавливать предел их содержания.
Анализ на доброкачественность лекарственного вещества проводится согласно ФС. ФС допускает наличие минимального количества примесей при условии, если они:
а) не изменяют фармакологического действия лекарственного средства;
б) не оказывают токсического действия на организм.
С аналитической точки зрения, все примеси, которые могут присутствовать в лекарственных веществах, условно делят на две группы.
1. Специфические примеси. Характерны только для данного вещества или группы близких по строению веществ. Сюда относятся примеси, попавшие в процессе получения, а также образовавшиеся при неправильном хранении.
Определение специфических примесей проводят по специальным методикам, приведенным в ФС на данное вещество.
2. Общие примеси. Могут встречаться во всех лекарственных средствах. Попадают в вещество в процессе получения из аппаратуры, растворителей или реактивов.
К общим примесям относят: хлориды, сульфаты, соли аммония, кальция, железа, цинка, тяжелых металлов, мышьяка (8 примесей).
С целью унификации испытаний на общие примеси разработаны общие методики исследования. Они приведены в ГФ XI, том 1, в ОФС «Испытания на чистоту и допустимые пределы примесей» (с. 165).
|
|
|
Для определения общих примесей используют обычные химические реакции.
1. Хлориды определяются по реакции с раствором серебра нитрата в азотнокислой среде:
(HNO3)
Cl– + AgNO3 ¾¾® AgCl ¯ + NO3–
Растворы хлоридов в зависимости от концентрации дают с раствором серебра нитрата белый творожистый осадок, белую муть или опалесценцию, не исчезающие от прибавления азотной кислоты. Предельная чувствительность реакции 0,0001 мг/мл.
2. Сульфаты определяют по реакции с раствором бария хлорида в среде хлороводородной кислоты:
(HCl)
SO42– + BaCl2 ¾¾® BaSO4 ¯ + 2Cl–
Растворы сульфатов в зависимости от концентрации дают с бария хлоридом белый осадок или опалесценцию, не исчезающую от прибавления разведенной хлороводородной кислоты. Предельная чувствительность реакции 0,003 мг/мл.
3. Аммиак (соли аммония) при взаимодействии с реактивом Несслера в зависимости от концентрации образуют желто-бурый осадок или желтое окрашивание. Щелочноземельные и тяжелые металлы осаждают предварительно раствором гидроксида натрия и карбоната натрия. Примеси железа маскируют тартратом калия-натрия в щелочной среде.
NH4Cl + 2K2[HgI4] + 4KOH ® [O á  ñ NH2] I – + 7KI + KCl + 3H2O
ñ NH2] I – + 7KI + KCl + 3H2O
2 Me2+ + Na2CO3 + 2NaOH ® ¯ MeCO3 ´ Me(OH)2 + 4Na+
Fe2+ + C4H4O6NaK ® Fe(C4H2O6KNa) + 2H+
Предельная чувствительность реакции 0,0003 мг/мл.
4. Соли кальция при взаимодействии с оксалат-ионами образуют белый осадок, белую муть или опалесценцию. Осадок легко растворим в минеральных кислотах, не растворим в уксусной кислоте.
(NH4Cl + NH4OH)
CaCl2 + (NH4)2 C2O4 ¾¾¾¾¾¾® ¯ CaC2O4 + 2NH4Cl
При определении примеси солей кальция в органических соединениях испытуемое вещество предварительно сжигают в присутствии концентрированной серной кислоты. Предельная чувствительность реакции – 0,0035 мг/мл.
5. Соли железа (II) и (III) в присутствии сульфосалициловой кислоты в аммиачной среде образуют комплексы коричнево-красного или желтого цвета.
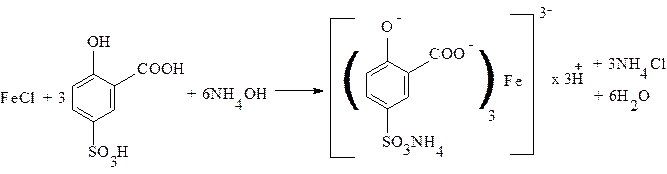 |
При определении примесей солей железа в органических соединениях используют зольный остаток после сжигания навески препарата с концентрированной серной кислотой. Определение для соединений магния проводится в присутствии хлорида аммония, для соединений алюминия – в присутствии гидроксида натрия. Предельная чувствительность реакции 0,00005 мг/мл.
|
|
|
6. Соли цинка образуют с растворами гексацианоферрата (II) калия белый осадок или муть. Осадок не растворим в минеральных кислотах.
3Zn(NO3)2 + 2K4[Fe(CN)6] ® ¯ Zn3K2[Fe(CN)6]2 + 6KNO3
Соли железа, мешающие реакции вследствие образования окрашенного осадка берлинской лазури, предварительно осаждают раствором аммиака.
Fe+3 + 3NH4OH ® ¯ Fe(OH)3 + 3NH4+
Предельная чувствительность реакции 0,001 мг/мл.
7. Соли тяжелых металлов образуют с натрия сульфидом или сероводородом черный осадок или бурое окрашивание.
Pb(CH3COO)2 + Na2S ® ¯ PbS + 2CH3COONa
Соли железа предварительно отделяют. Органические соединения предварительно минерализуют концентрированной серной кислотой.
8. Примеси соединений мышьяка в зависимости от состава исследуемого вещества и наличия других примесей определяют двумя методами:
Метод 1. Применяется для соединений, не содержащих примеси солей селена, теллура, а также препаратов сурьмы, висмута, серебра, ртути, сульфитов, сульфидов и фосфора.
Метод основан на восстановлении соединений мышьяка (III) и мышьяка (V) водородом до мышьяковистого водорода (арсина) и последующим образованием окрашенных солей с хлоридом ртути (II).
В зависимости от концентрации мышьяка появляется оранжевая или желтая окраска, при действии раствора йодида калия – буровато-коричневая.
Zn + H2SO4 ® ZnSO4 + H2
As2O3 + 6H2 ® 2AsH3 + 3H2O
As2O5 + 8H2 ® 2AsH3 + 5H2O
AsH3 + HgCl2 ® AsH2(HgCl)+ HCl
AsH3 + 2HgCl2 ® AsH(HgCl)2+ 2HCl
AsH3 + 3HgCl2 ® As(HgCl)3+ 3HCl
AsH3 + As(HgCl)3 ® As2Hg3+ 3HCl
2As2Hg3+ 3HgCl2 ® ¯ 2As+ As2Hg3 · Hg2Cl2+ 2Hg2Cl2¯
Неорганические вещества, не содержащие азотной кислоты, нитратов, нитритов, не выделяющие в условиях реакции галогенов, оксидов серы и фосфинов, исследуют в присутствии хлороводородной кислоты.
Для определения примеси мышьяка в присутствии азотной кислоты, нитратов, нитритов и соединений, выделяющих галогены, сероводород, оксид серы (IV) и фосфины, навеску испытуемого вещества предварительно кипятят с концентрированной серной кислотой в течение 40 мин, затем по стенке прибавляют пергидроль, нагревают еще 10-15 мин и далее определяют примесь мышьяка.
|
|
|
Органические соединения предварительно минерализуют концентрированной серной кислотой (кипятят после обугливания 40 мин, после обесцвечивания пергидролем – 15 мин).
Выделяющиеся пары сероводорода и других газов поглощаются ватой, пропитанной раствором ацетата свинца.
Метод 2. Метод Буго-Тиле применяется для соединений, содержащих теллур, селен, сурьму, висмут, ртуть, серебро, сульфиды, сульфиты, фосфор. Метод основан на восстановлении соединений мышьяка фосфорноватистой кислотой (гипофосфитом натрия) до свободного мышьяка. Реакция протекает в кислой среде. При наличии мышьяка появляется бурое окрашивание или бурый осадок.
NaH2PO2 + HCl ® NaCl + H3PO2
As2O3 + 3H3PO2 ® ¯ 2As + 3H3PO3
As2O5 + 5H3PO2 ® ¯ 2As + 5H3PO3
Процесс восстановления идет в две стадии:
2H3PO2 ® H3PO4 + РН3
As2O3 + PН3 ® ¯ 2As + H3PO3
При образовании бурого осадка или побурения смесь обрабатывают водой и эфиром. О наличии мышьяка свидетельствует бурая пленка на границе жидкостей.
В ФС на индивидуальное лекарственное вещество обычно указывается допустимое содержание примеси в данном веществе в процентах (например, не более 0,01% хлоридов, 0,02% сульфатов и т.д.). Следовательно, при анализе нужно не просто провести качественную реакцию на данную примесь, но и дать количественную оценку содержания примеси в лекарственном веществе. Для этого используется прием сравнения с эталонным раствором (т.е. эталонный способ).
Эталонный раствор – это раствор, содержащий точно известное минимальное количество испытуемой примеси. Для каждой примеси имеется свой эталонный раствор. Каждый эталонный раствор имеет строго определенную, постоянную концентрацию. При выборе концентрации были учтены различные факторы: чувствительность реакций, лежащих в основе определения примесей; наиболее часто встречающееся содержание данной примеси в лекарственных веществах и т.д. Эталонный раствор готовят путем растворения навески исходного вещества, содержащего нужный ион, в определенном объеме растворителя. Исходное вещество подобрано такое, чтобы оно имело постоянный состав; могло быть легко получено в химически чистом виде.
В ОФС приведены 8 эталонных растворов.
| Наименование эталона | Концентрация иона в эталоне | Исходное вещество для приготовления | Реактив для определения иона | Чувствительность реакции, | |
| (ионы) | мг/мл | % | эталона | мг/мл | |
| Cl– | 0,002 | 0,0002 | NaCl | AgNO3 | 0,0001 |
| SO42– | 0,01 | 0,001 | K2SO4 | BaCl2 | 0,003 |
| NH4+ | 0,002 | 0,0002 | NH4Cl | Реактив Несслера | 0,0003 |
| Ca2+ | 0,03 | 0,003 | CaCO3 | (NH4)2C2O4 | 0,0035 |
| Fe3+ | 0,003 | 0,0003 | Fe(NH4)(SO4)2·12H2O | Кислота сульфосалициловая | 0,00005 |
| Zn2+ | 0,005 | 0,0005 | ZnO | K4[Fe(CN)6] | 0,001 |
| Pb2+ | 0,0005 | 0,00005 | Pb(CH3COO)2·3H2O | Na2S | 0,0005 |
| As3+ | 0,001 | 0,0001 | As2O3 | HgCl2 | 0,0005 |
|
|
|
Эталонный раствор содержит очень небольшое количество иона, поэтому вначале готовят концентрат, и затем его разбавляют водой до нужной концентрации.
Принцип расчета навески для приготовления эталонного раствора
1. Находят по ОФС титр эталонного раствора, т.е. содержание иона в мг в 1 мл эталонного раствора:  , который пересчитывают на содержание г/мл.
, который пересчитывают на содержание г/мл.
2. Титр эталонного раствора пересчитывают на титр исходного вещества (соли), из которого готовят раствор.
Т соли =  ´ Кпер.
´ Кпер.
 , где
, где
n - число ионов в молекуле.
3. Исходя из титра соли и объема эталонного раствора рассчитывают навеску соли.
а соли = Т соли ´ V эт. р-ра
4. Проводят произвольное увеличение навески до минимально возможной для взятия на аналитических весах (т.е. не менее 0,05 г). Увеличивают в число раз, кратное 10: 10, 100, 1000 раз.
5. Рассчитывают разведение концентрата до концентрации эталонного раствора (с учетом объема аликвота не менее 1 мл). Концентрат разводят во столько раз, во сколько раз была увеличена навеска.
|
|
|


