 |
Кондуктометрический метод анализа
|
|
|
|
Задание
Для раствора электролита по приведенным данным определите параметры, обозначенные через «Х».
| Номер варианта | Электролит, С, моль/л | Электроды | mA, I | B, U | Ом, R | Ом–1.см–1, s | l, см2/ Ом×моль |
| 0,1 | S = 5,33 см2 l = 0,82 см | – | – | 28,6 | Х | Х | |
| 0,1 | Круглые, d = 1см l = 4 см | 0,6 | Х | Х | Х | ||
| 0,1 | S = 1 см2 l = 0,5 см | – | – | Х | Х | ||
| 0,1 | S = 5 см2 l = 1 см | – | – | Х | Х | 79,2 | |
| 0,1 | S = 0,865 см2 l = 0,3 см | – | – | Х | Х | 123,94 |
О к о н ч а н и е т а б л и ц ы
| Номер варианта | Электролит, С, моль/л | Электроды | mA, I | B, U | Ом, R | Ом–1.см–1, s | l, см2/ Ом×моль |
| 0,2 | S = 2 см2 l = Х | 1,0 | Х | Х | |||
| 0,5 | S = 5,6 см2 l = 1,8 см | – | – | Х | 0,02 | Х | |
| 1,0 | S = 6 см2 l = 1 см | – | – | Х | Х | ||
| 0,1 | Квадратные стороны 1 см, l = 0,5 см | – | – | Х | Х | 94,3 | |
| 0,05 | S = 5 см2 l = 0,8 см | – | – | Х | Х | ||
| 0,1 | Круглые, d = 1 см l = 1 см | 0.5 | Х | Х | Х | ||
| 1,0 | S = Х l = 1 см | – | – | Х | |||
| 0,05 | S = 1 см2 l = Х | 1,0 | Х | Х | |||
| Х | S = 5 см2 l = 1 см | – | – | Х | 0,01 | ||
| 0,1 | Круглые, d = 1,2 см l =1 см | 0,6 | Х | Х | Х | ||
| 0,05 | Квадратные, стороны 1,5 см, l = 1 см | – | – | Х | Х | ||
| Х | S = 1 см2 l = Х | – | – | 0,1 | |||
| 1,0 | S = 1 см2 l = 2,5 см | 0,5 | Х | Х | Х | ||
| 0,1 | S = Х l = 2 см | – | – | Х | |||
| – | S = 5,6 см2 l = 1,8 cм | – | – | X | 0,2 | - | |
| 0,1 | Круглые, d = 1,5 см; l = 1 см | 2,5 | 0,2 | Х | Х | Х | |
| 0,005 | S = 0,865 cм2 l = 0,26 см | – | – | Х | Х | ||
| 0,0003 | S = 2,54 см2 l = 0,35 см | – | – | 5,6 | Х | Х | |
| 0,1 | S = 1,5 см2 l = 0,75 см | – | – | 46,8 | Х | Х | |
| 0,05 | Круглые, d =1,5 см l = 1,5 см | – | – | Х | 0,05 | Х |
5.2. Вопросы и упражнения
1. какая зависимость положена в основу метода прямой кондуктометрии: а) зависимость силы тока от электрического сопротивления раствора; б) зависимость электрической проводимости от концентрации определяемого вещества?
|
|
|
2. Что называют удельной проводимостью и эквивалентной электрической проводимостью? Укажите их размерность и запишите уравнение связи между ними.
3. Какой из перечисленных растворов концентрации 0,1 моль/л имеет наименьшую электрическую проводимость: а) HCl; б) NaCl; в) AlCl3; г) СН3СООН?
4. Какой прибор пригоден для измерения электрической проводимости растворов: а) мост постоянного тока; б) мост переменного тока; в) потенциометр постоянного тока?
5. Что называют константой измерительной ячейки? Как экспериментально определяют эту величину?
6. Как влияют на электрическую проводимость: а) свойства электролита; б) концентрация ионов и их подвижность?
7. Дайте определение удельной и молярной электропроводности. Укажите факторы, которые влияют на их величину. Перечислите достоинства и недостатки, области применения прямой кондуктометрии.
8. Как влияют на электрическую проводимость: а) температура; б) вязкость растворителя и его диэлектрическая проницаемость?
9. Какой вид имеют кривые кондуктометрического титрования для реакций: а) титрования сильной кислоты сильным основанием; б) осаждения?
10. Какой вид имеет кривая кондуктометрического титрования соляной кислоты раствором гидроксида аммония? Объясните вид кривой титрования. Как определяют объем в конечной точке титрования и рассчитывают массу определяемого вещества? Какие электроды можно использовать для данного титрования?
11. Какой вид имеют кривые кондуктометрического титрования для реакций: а) слабой кислоты сильным основанием; б) комлексообразования?
12. На рисунке приведены кривые кондуктометрического титрования для реакций кислотно-основного взаимодействия? Какая из кривых соответствует: а) титрованию сильной кислоты сильным основанием; б) титрованию слабой кислоты сильным основанием?

|
|
|
13. Какой вид будет иметь кривая кондуктометрического титрования для реакций осаждения, если: а) подвижность осаждаемых ионов больше подвижности ионов осадителя; б) подвижности ионов осадителя и осаждаемых ионов примерно одинаковы; в) подвижность ионов осадителя больше подвижности осаждаемых ионов?
14. Какой вид имеет кривая кондуктометрического титрования нитрата бария раствором сульфата натрия? Покажите, как определяют на ней эквивалентный объем и напишите расчетную формулу массы сульфата бария в растворе.
15. Какой вид имеет кривая кондуктометрического титрования смеси уксусной и соляной кислот раствором гидроксида натрия? Объясните вид кривой титрования. Как определяют объем в конечной точке титрования и рассчитывают массу определяемых компонентов?
16. Какой вид имеет кривая кондуктометрического титрования раствора гидроксида аммония серной кислотой? Покажите как определяют на ней эквивалентный объем и напишите формулу для расчета массы гидроксида аммония в растворе.
17. Какой вид имеет кривая кондуктометрического титрования смеси гидроксида калия и гидроксида аммония раствором соляной кислоты? Как определяют объем в конечной точке титрования и напишите формулу для расчета массы определяемых веществ?
18. Какой вид будет иметь кривая кондуктометрического титрования для реакций осаждения, если подвижности ионов осадителя и осаждаемых ионов примерно одинаковы. Дайте пояснение.
19. Какой вид будет иметь кривая кондуктометрического титрования для реакций осаждения, если подвижность ионов осадителя больше подвижности осаждаемых ионов? Дайте пояснение.
20. Какой вид имеет кривая кондуктометрического титрования соляной кислоты раствором гидроксида натрия? Как определяют объем в конечной точке титрования и рассчитывают массу соляной кислоты в растворе? Укажите используемые в данном методе приборы и электроды.
6. Кулонометрический метод анализа
6.1. Задание
По приведенным данным определить параметр, обозначенный через «Х». Выход по току принять за 100 %. Для металла Меn+ определить, какой это металл.
| Номер варианта | Вещество или ион | Сила тока, А | Электрохимический эквивалент | Время, мин | Масса выделенного вещества |
| Ме2+ | 0,5 | 0,658 мг/Кл | Х | 128 мг | |
| Ме3+ | Х | 3,5 | 0,4548 г | ||
| Ме2+ | 1,8 | 0,3054 мг/Кл | 1,42 | Х, мг | |
| Раствор соли серебра | 2,5 | 4,025 г/А.ч | Х | 0,5450 г | |
| Расплав KCl | Х | 0,368 мг/кл | 1,5 | 0,25 л Cl2 | |
| Ме3+ | 0,093 мг/кл | Х | 3,78 г | ||
| Раствор CdСl2 | Х | – | 2.5 | 0,300 г | |
| Ме+ | 0,35 | Х, мк/кл | 2,35 | 0,1037 г | |
| FeCl3 раствор | 4,0 | – | Х | 0,100 г | |
| Ме3+ | 1,8 | 0,5430 мг/кл | 1 мин 25 с | Х, мг | |
| Ме3+ | 3,0 | Х | 0,5815 г | ||
| Расплав LiCl | Х | 0,073 мг/кл | 0,1 г Li | ||
| Ме3+ | 1,0 | Х | 0,3772 г | ||
| Раствор CuSO4 | 2.0 | – | 3,2 | Х, мг | |
| Ме+ | 3,0 | 1,12 мг/кл | 4,1 | Х, г | |
| Ме+ | 2,3 | 2,04 мг/кл | Х | 0,3 г | |
| Ме3+ | 1,9 | 0,68 мг/кл | Х, г | ||
| Ме2+ | Х | 1,04 мг/кл | 2,0 | 0,17 г | |
| Ме2+ | 1,5 | 0,583 мг/кл | Х | 0,13 г | |
| Раствор AgNO3 | Х | – | 4,5 | 0,22 г | |
| Ме2+ | 0,2 | 0,329 мг/Кл | Х, мг | ||
| Ме3+ | 1,0 | Х | 6,5×105 мкг | ||
| Ме3+ | 1,0 | Х | 0,575 г | ||
| – | 2,5 | 1,97 г/(А.ч) | Х, г | ||
| Ме2+ | Х | 0,550 мг/кл | 4,0 | 0,17 г |
6.2. Вопросы и упражнения
|
|
|
1. Что представляет собой выход по току и каким образом его учитывают в расчетах?
2. При кулонометрическом титровании количество электричества определяют: а) как произведение силы тока и времени генерирования реагента до достижения конечной точки титрования; б) измеряя продолжительность титрования к моменту скачка потенциала; в) измеряя вблизи точки эквивалентности изменение тока электролиза в единицу времени.
3. Как изменяется электрохимический эквивалент металлов в ряду периодической системы при переходе от I к III группе?
4. В чем сущность методов прямой кулонометрии и кулонометрического титрования? Можно ли вести кулонометрическое титрование при постоянном потенциале?
5. В основу кулонометрического титрования положено: а) соответствие потенциала одного из электродов ячейки потенциалу окисления (восстановления) вещества, присутствующего в растворе; б) способность вещества к электрохимическому превращению на поверхности твердого электрода; в) соответствие между количеством электричества, прошедшего через ячейку, и количеством электрогенерируемого реагента.
6. Какие законы положены в основу кулонометрических определений?
|
|
|
7. Какими методами измеряют количество электричества в кулонометрии?
8. Привести примеры кулонометрического титрования: а) электрогенерированными окислителями; б) с использованием реакций кислотно-основного взаимодействия.
9. Привести примеры кулонометрического титрования: а) электрогенерированными восстановителями; б) с использованием реакций осаждения и комплексообразования.
10. Указать достоинства и недостатки кулонометрических методов анализа.
11. Какой из электрохимических методов титрования позволяет исключить стандартизацию титранта: а) амперометрический; б) потенциометрический; в) кулонометрический; г) кондуктометрический?
12. При кулонометрическом титровании кислот в качестве вспомогательного реагента используется: а) вода; б) сульфат калия; в) нитрат калия; г) гидроксид натрия.
13. Отличие кулонометрического титрования от других типов титрования заключается в том, что: а) можно сразу прибавить весь объем титранта; б) реагент образуется в результате электродной реакции; в) при титровании нет необходимости измерять объем титранта; г) нельзя применять прямое титрование.
14. Сформулировать основные законы электролиза.
15. В основу прямой кулонометрии положено: а) измерение электродного потенциала в ходе электролиза; б) измерение массы вещества, подвергающегося электрохимическому превращению; в) определение количества электричества, затрачиваемого на электрохимическое превращение вещества; г) контроль всех трех факторов.
16. Основное условие для использования в анализе метода кулонометрического титрования заключается: а) в электрогенерировании реагента со 100 %-й эффективностью использования тока и количественном химическом взаимодействии реагента с определяемым веществом; б) в непосредственном превращении определяемого вещества на одном из электродов ячейки; в) в применении кулонометра, включенного последовательно в цепь ячейки; г) в поддержании при титровании постоянства силы тока.
17. Описать устройство и принцип действия серебряного титрационного кулонометра и газового кулонометра.
18. Назовите наиболее распространенные способы фиксирования точки эквивалентности в кулонометрическом титровании.
19. Отличительное преимущество кулонометрического титрования перед амперометрическим заключается: а) в простоте и доступности аппаратуры; б) высокой чувствительности и более широком круге реакций; в) экспрессности; г) отсутствии необходимости приготовления стандартных растворов, возможности использования неустойчивых реагентов и высокой точности.
20. Описать устройство и принцип действия медного кулонометра.
|
|
|
7. Полярография и амперометрическое
титрование
7.1. Задание. Полярография
1–4. При полярографировании стандартных растворов свинца (II) получили следующие результаты:
| С Pb×106, г/мл | 0,50 | 1,00 | 1,50 | 2,00 |
| h, мм | 4,0 | 8,0 | 12,0 | 16,0 |
Навеску алюминиевого сплава массой m растворили и раствор разбавили до 50 мл. Высота полярографической волны свинца в полученном растворе оказалась равной hx.
Вычислить массовую долю (%) свинца в анализируемых образцах:
| Вариант | ||||
| m, г | 2,500 | 5,134 | 5,2 | 5,300 |
| hх, мм | 6,0 | 9,0 | 10,0 | 11,0 |
5–8. Для построения градуировочного графика записали полярограммы четырех стандартных растворов меди (II) и измерили высоту волны h (мм):
| С Cu×103, г/мл | 0,50 | 1,00 | 1,50 | 2,00 |
| h, мм | 9,0 | 17,5 | 26,2 | 35,0 |
Навеску латуни массой m (г) растворили и раствор разбавили до 50,00 мл.
Вычислить массовую долю (%) меди в анализируемых образцах, если высота волны на полярограммах оказалась равной hx:
| Вариант | ||||
| m, г | 0,0690 | 0,1000 | 0,1200 | 0,1400 |
| hx, мм | 11,0 | 18,0 | 23,0 | 30,0 |
9–12. Для построения градуировочного графика растворили одинаковые навески четырех стандартных образцов стали, содержащих хром, сняли их полярограммы и измерили высоту полярографической волны:
| Образец | ||||
| wCr, % | 0,30 | 0,42 | 0,96 | 1,40 |
| h, мм | 6,0 | 8,4 | 19,4 | 28,0 |
Определить массовую долю (%) хрома в анализируемых образце, если при полярографировании раствора, полученного в аналогичных условиях, высота полярографической волны оказалась равной hx:
| Вариант | ||||
| hx, мм | 12,0 | 14,0 | 18,0 | 22,0 |
13–16. Для определения марганца в стали методом добавок навеску m стали растворили в смеси кислот и после отделения мешающих ионов разбавили раствор до 200,0 мл. Аликвоту 20,00 мл поместили в электролизер и измерили высоту полярографической волны h 1при
Е = – 1,55 В. После добавления в электролизер V ст стандартного раствора 0,05 М MnSO4 высота волны стала равной h 2. Вычислить массовую долю марганца в образце:
| Вариант | ||||
| m,г | 1,6500 | 1,6030 | 1,2900 | 1,2600 |
| h 1,мм | 22,5 | 20,5 | 18,5 | 17,0 |
| V ст, мл | ||||
| h 2, мм | 35,0 | 33,0 | 43,5 | 42,0 |
17–20. Для определения свинца в цинковой руде методом добавок навеску руды массой m растворили в смеси кислот, восстановилижелезо (III), добавили желатину и разбавили раствор до 200,0 мл. Аликвоту объемом 20,00 мл поместили в электролизер и измерили высоту h 1 полярографической волны при Е = – 0,45 В. При этих условиях ионы меди, цинка и кадмия не мешают определению свинца. После добавления в электролизер стандартного раствора V ст 0,002 М Pb(NO3)2 получили волну h 2.
Рассчитать массовую долю (%) свинца в руде для следующих вариантов:
| Вариант | ||||
| m, г | 1,000 | 2,266 | 2,268 | 3,073 |
| h 1,мм | 22,0 | 25,0 | 26,5 | 28,5 |
| V ст,мл | 10,00 | 5,00 | 5,00 | 2,00 |
| h 2, мм | 42,00 | 35,0 | 36,5 | 32,5 |
21–24. Для определения кадмия в сплаве методом добавок навеску массой m растворили в смеси кислот и раствор разбавили до 250,0 мл. Аликвоту объемом 20,00 мл полярографировали и измерили высоту полярографической волны кадмия. Другие компоненты сплава в этих условиях не мешали определению кадмия. После добавления в электролизер стандартного раствора V ст 0,03 М CdSO4 высота волны увеличилась до h 2.
Определить массовую долю (%) кадмия в сплаве для следующих вариантов:
| Вариант | ||||
| m, г | 3,542 | 4,130 | 3,508 | 3,746 |
| h 1,мм | 19,0 | 20,5 | 16,5 | 18,5 |
| V ст,мл | 10,00 | 2,00 | 5,00 | 5,00 |
| h 2, мм | 29,0 | 22,5 | 21,5 | 23,5 |
25. При полярографировании 15 мл раствора соли цинка высота волны была 29,5 мм. После прибавления 2 мл стандартного раствора
с концентрацией цинка 0,000256 н. высота волны увеличилась на
12 мм. Определить концентрацию цинка в анализируемом растворе
(в моль/л).
7.2. Задание. Амперометрическое титрование
1–10. Определить концентрацию (мг/л) цинка в исследуемом растворе, если при амперометрическом титровании 10,00 мл этого раствора раствором K4[Fe(CN)6] c T (K4[Fe(CN)6/Zn) = 0,00244 г/см3 получили следующие результаты:
| V (K4[Fe(CN)6], мл | Id, для вариантов | |||||||||
| 0,00 | 30,0 | 20,0 | 20,0 | 30,0 | 30,0 | 30,0 | 44,0 | 60,0 | 75,0 | 75,0 |
| 0,20 | 30,0 | 20,0 | 20,0 | 31,0 | 29,0 | 30,0 | 45,0 | 60,0 | 75,0 | 75,0 |
| 0,40 | 31,0 | 31,0 | 21,0 | 30,0 | 31,0 | 30,0 | 45,0 | 60,0 | 75,0 | 75,0 |
| 0,50 | 40,0 | 40,0 | 22,0 | 32,0 | 32,0 | 30,0 | 45,0 | 61,0 | 75,0 | 75,0 |
| 1,00 | 94,0 | 94,0 | 60,0 | 80,0 | 32,0 | 31,0 | 46,0 | 61,0 | 75,0 | |
| 1,50 | 60,0 | 32,0 | 46,0 | 75,0 | ||||||
| 2,00 | 46,0 | 75,0 | ||||||||
| 2,50 | – | – | – | – | ||||||
| 3,00 | – | – | – | – |
11–15. Определить концентрацию (мг/л) никеля в исследуемом растворе, если при амперометрическом титровании 20,00 мл этого раствора спиртовым раствором диметилглиоксима (ДМГ) с
Т (ДМГ/Ni) = 0,00203 г/см3 получили следующие результаты:
| V (ДМГО), мл | Диффузионный ток Id, для вариантов | ||||
| 0,0 | |||||
| 0,5 | |||||
| 1,0 | |||||
| 1,5 | |||||
| 2,0 | |||||
| 2,5 | |||||
| 3,0 | |||||
| 3,5 | |||||
| 4,0 |
16–20. Определить концентрацию свинца (мг/л), если при амперометрическом титровании 10,00 мл этого раствора раствором Na2SO4 с Т (Na2SO4/Pb) = 0,00640 г/см3 получили данные:
| V (Na2SO4), мл | Диффузионный ток Id, мкА, для вариантов | ||||
| 0,0 | |||||
| 0,5 | |||||
| 1,0 | |||||
| 1,5 | |||||
| 2,0 | |||||
| 2,5 |
21–25. Определить концентрацию меди (мг/л), если при амперометрическом титровании 50,00 мл этого раствора раствором 0,01 М ЭДТА получили данные:
| V (ЭДТА), мл | Диффузионный ток Id, мкА, для вариантов | ||||
| 0,00 | 22,5 | 17,0 | 23,5 | 27,0 | 18,75 |
| 0,50 | 16,0 | 11,0 | 17,7 | 19,2 | 13,35 |
| 1,00 | 10,0 | 5,00 | 11,7 | 12,0 | 8,35 |
| 1,50 | 3,75 | 0,50 | 5,75 | 4,5 | 3,125 |
| 2,00 | 0,50 | 0,50 | 0,50 | 0,6 | 0,415 |
| 2,50 | 0,50 | 0,50 | 0,50 | 0,6 | 0,415 |
| 3,00 | 0,50 | 0,50 | 0,50 | 0,6 | 0,415 |
7.3. Вопросы и упражнения
1. В чем сущность метода классической полярографии? Из чего состоит электролитическая ячейка в данном методе? При идентификации вещества методом классической пролярографии измеряют:
а) высоту полуволны; б) потенциал полуволны; в) потенциал начала восстановления деполяризатора; г) высоту волны.
2. Начертить поляризационную кривую (полярограмму) и охарактеризовать ее отдельные участки.
3. Приведите примеры количественного полярографического анализа (метод градуировочного графика, метод стандартов, метод добавок).
4. Приведите уравнение полярографической волны и поясните смысл входящих в него величин.
5. В чем сущность качественного полярографического анализа? Привести примеры.
6. Какие факторы и как влияют на величину диффузионного тока в полярографии (уравнение Ильковича)?
7. Объясните причину появления максимумов на полярографической кривой. Как они устраняются?
8. С какой целью вводится фоновый электролит при полярографических определениях? Каким требованиям должен он удовлетворять?
9. Какие электроды используют в вольтамперометрии? Каковы их особенности?
10. От каких факторов зависит потенциал полуволны? Для нахождения концентрации вещества по методу градуировочного графика на вольтамперограммах следует определять: а) потенциал полуволны; б) высоту волны; в) область потенциалов предельного тока.
11. Какой вид имеет вольт-амперная кривая? Указать основные ее характеристики. Какие из них используются в качественном и количественном анализе? При идентификации одного или нескольких ионов на вольтамперограмме следует определить _____ каждого из ионов: а) высоту волны; б) потенциал начала восстановления; в) потенциал полуволны.
12. Как зависит величина предельного (диффузионного) тока от концентрации электроактивного иона, рН раствора, концентрации индифферентного электролита, природы растворителя, температуры?
13. Интервал значений потенциала индикаторного электрода, соответствующий предельному току, правильно указан на рисунке:




14. Назвать области применения, достоинства и недостатки амперометрического титрования. Кривая амперометрического титрования отражает: а) зависимость тока от концентрации при постоянном потенциале и R, стремящемся к бесконечности; б) зависимость потенциала от концентрации при постоянном токе; в) зависимость тока от потенциала; г) зависимость тока от концентрации при постоянном потенциале и R, стремящемся к нулю.
15. В чем сущность амперометрического титрования? Выбор потенциала для амперометрического титрования по току электроактивного вещества показан на рисунке:


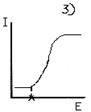
16. В ходе амперометрического титрования ток до точки эквивалентности падает, а после точки эквивалентности возрастает, если электроактивны: а) определяемое вещество и продукт химической реакции; б) определяемое вещество и реагент; в) реагент и продукт химической реакции.
17. Назвать области применения, достоинства и недостатки вольтамперометрического анализа.
18. Что общее и какие различия между амперометрическим титрованием и полярографией?
19. Какой вид имеет кривая амперомерического титрования FeSO4 раствором дихромата калия? Объясните кривую титрования. Как определяют объем в конечной точке титрования?
20. Можно ли титровать методом амперометрического титрования мутные, цветные растворы и растворы веществ электрохимически неактивных. Привести примеры.
8. Хроматографический метод анализа
8.1. Задание
1. Рассчитать массовую долю компонента смеси газов по данным, полученным при газохроматографическом разделении смеси.
| Газ | S | K |
| Пропан Бутан Пентан Циклогексан | 1,13 1,11 1,11 1,08 |
2. Для определения диоксидифенилметана в пищевых продуктах используют метод тонкослойного хроматографического разделения и количественного определения по площади пятна S и интенсивности фототока I. Для стандартных образцов были получены данные:
| Концентрация диоксидифенилметана, мкг/0,02 мл | 1,25 | 2,56 | 6,40 | 18,2 | 33,1 | 77,3 |
| Площадь пятна S, мм2 | ||||||
| Интесивность фототока отражения, мА | 2,3 | 2,8 | 3,4 | 4,3 | 5,1 | 7,2 |
Для построения градуировочного графика использована зависимость lg (S × I)отlg C. Обработали 150 г овощей в 100 мл спирта, который затем упарили до 10 мл. От 0,02 мл этого раствора при хроматографировании получено пятно площадью 35,0 мм2 с интенсивностью фототока отражения 2,5 мА. Определить содержание диоксифенилметана в овощах (мкг/кг).
3. При определении этилового спирта методом газовой хроматографии были получены следующие пики в зависимости от содержания:
| С, мг/0,02 мл | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
| h, мм |
Для 0,02 мл исследуемого раствора получен пик высотой 57 мм. Определить содержание спирта в исследуемом растворе (%), если плотность раствора 0,95 г/см3.
4. Смесь катионов, содержащаяся в молоке, при разделении в тонком слое окиси алюминия с помощью ацетона, содержащего 8 % воды и 8 % конц. HCl, дала после проявления K4 [Fe(CN)6] 3 пятна со значением Rf: 0,27; 0,56; 0,69. Пробы катионов-свидетелей имеют следующие значения Rf: Ni2+ – 0,27; Co2+ – 0,44; Cu2+ – 0,57; Fe3+ – 0,69. Определить катионы, входящие в состав молока, а также их нормальную концентрацию в продукте по формуле C = K × А × S, если известно, что
К = 0,2, площади пятен на хроматограмме для Ni2+, Co2+, Cu2+ и Fe3+ равны соответственно (мм2): 40, 42, 50, 45, а их оптические плотности 0,0125; 0,0120; 0,020 и 0,0165.
5. Для хроматографического определения никеля на бумаге, пропитанной раствором диметилглиоксима, приготовили три стандартных раствора. Для этого навеску 0,2480 г NiCl2.6H2O растворили в мерной колбе на 50 мл. Затем из этой колбы взяли 5, 10 и 20 мл и разбавили в колбах на 50 мл. Испытуемый раствор тоже разбавили до 50 мл. Высота пиков стандартных растворов равна 25,5; 37,5 и
61,3 мм, а высота пика исследуемого раствора – 49,0 мм. Определить содержание Ni (мг/мл) в исследуемом растворе.
6. Рассчитать массовую долю (%) компонентов смеси по следующим данным, полученным методом газовой хроматографии:
| Вариант | Газ | S, мм2 | К |
| Этанол Метанол Метан Этан Динитробензол Нитробензол Этилацетат Этанол | 0,64 0,58 1,23 1,15 1,22 1,07 0,79 |
7. Рассчитать содержание этана (%) в смеси по следующим данным, полученным методом газовой хроматографии:
| Газ | S, мм2 | К |
| Этан Пропан Бутан Пентан | 0,77 1,00 1,11 0,60 |
8. Методом хроматографии на бумаге, пропитанной гексацианоферратом (II) калия, были получены следующие площади пятен в зависимости от концентрации стандартных растворов меди:
| С, мг/0,2 см3 | 0,12 | 0,30 | 0,45 | 0,70 | 0,90 |
| S, мм2 | 26,3 | 52,5 | 66,5 |
При анализе творога 50,0 г его озолили, золу растворили в 100 см3 кислоты и пипеткой нанесли на хроматографическую бумагу 0,2 см3 полученного раствора. После хроматографического разделения определили площадь пятна для гексацианоферрата меди, которая оказалась равной 30,1 мм2. Рассчитайте содержание меди в твороге (мг/кг).
9. При анализе смеси аминокислот методом бумажной хроматографии были получены три пятна с Rf = 0,18, Rf = 0.36, Rf = 0.54 и площадью S 1 = 0,74 см2, S 2 = 0,52 см2, S 3 = 0,29 см2 соответственно. При анализе в тех же условиях для чистых аминокислот величины Rf была равна для лизина – 0,22; для серина – 0,36; для аланина – 0,42; для гистидина – 0,54; для валина – 0,68; для цистеиновой кислоты – 0,18. Каков качественный и количественный (в %) состав смеси?
10. Рассчитать массовую долю (%) компонентов газовой смеси по следующим данным, полученным методом газовой хроматографии:
| Газ | S, мм2 | K |
| Бензол Гексан Пропилен Этанол | 1,0 1,1 1,1 1,8 |
11. При анализе стандартных растворов хлорида натрия методом ионной хроматографии были получены следующие данные:
| С ст., мг/дм3 | |||||
| S ст, мм2 | 14,0 | 20,1 | 25,8 | 32,0 | 38,0 |
Определите концентрацию хлорид-ионов в минеральной воде, если площадь пика хлорид-иона на хроматограмме равна 29,6 мм2.
12. При определении этанола методом газожидкостной хроматографии в качестве внутреннего стандарта использовали пропанол. Рассчитайте содержание этанола в водке по данным хроматографического анализа: а) при градуировке масса этанола 0,052 г, площадь пика этанола 5,36 см2, масса пропанола 0,068 г, площадь пика пропанола 8,41 см2; б) при анализе водки: площадь пика этанола 6,48 см2, масса водки 0,2101 г, масса пропанола 0,049 г, площадь пика пропанола 6,06 см2.
13. Рассчитайте общую массовую долю примесей в фальсифицированном спирте по данным, полученным с помощью газовой хроматографии:
| Компоненты смеси | Площадь пика, S, мм2 | Поправочный коэффициент, К |
| Этанол Пропанол Метанол Ацетальдегид Вода | 115,1 3,2 1,3 1,5 5,8 | 0,84 0,72 1,00 0,90 1,10 |
14. При анализе серии стандартных растворов тиамина методом ионной хроматографии были получены следующие данные:
| С, мкг/см3 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| S, мм2 | 0,32 | 0,44 | 0,55 | 0,67 | 0,78 |
Чему равна массовая доля тиамина в пищевом продукте, если из 10 г его был получено 100 мл раствора и измеренная в тех же условиях площадь равная 0,46.
15. При определении адипиновой кислоты в продукте гидрокарбоксилирования бутадиена методом бумажной хроматографии пятна, проявленные метиловым красным, вырезали, высушили и взвесили. Для стандартных растворов при различном содержании адипиновой кислоты были получены следующие данные:
| Масса кислоты, мкг | |||||
| Масса бумаги с пятном, мг |
Навеску анализируемого продукта 100 мг растворили в 10 мл воды и три порции полученного раствора по 0,02 мл хроматографировали. Масса пятен была 105, 98 и 109 мг. Определить массовую долю адипиновой кислоты в анализируемом продукте (в %).
16. Рассчитать процентный состав смеси газов по следующим данным, полученным при газовой хроматографии смеси:
| Газ | бензол | толуол | этилбензол | кумол |
| Площадь пика, S, мм2 | 20,6 | 22,9 | 30,5 | 16,7 |
17. Для определения диоксифенилметана (ДДМ) в овощах использовали метод тонкослойного хрома
|
|
|


