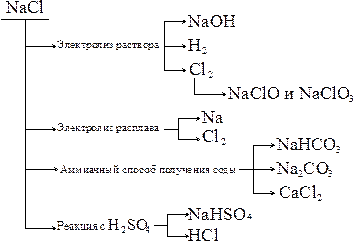Пероксиды s-элементов I группы взаимодействуют с кислотами с образованием пероксида водорода:
Me2O2 + 2H+ ® 2Me+ + H2O2.
Растворяясь в воде, они подвергаются почти полному гидролизу:
Na2O2 + 2H2O ® 2NaOH + H2O2.
Во влажном воздухе разлагаются:
2Li2O2 ® 2Li2O + O2.
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов: LiOH, NaOH, KOH, RbOH, CsOH, FrOH - бесцветные кристаллические вещества, гигроскопичны и хорошо (за исключением LiOH) растворяются в воде с выделением тепла.
Их называют щелочами. Водные растворы щелочей - сильные электролиты: MeOH ® Me+ + OH-.
Из всех гидроксидов щелочных металлов наибольшее практическое значение имеют NaOH и KOH.
NaOH – гидроксид натрия (едкий натр, каустическая сода, каустик) - бесцветные, непрозрачные гранулы, пластинки или чешуйки, очень гигроскопичны, хорошо растворяются в воде с сильным разогреванием раствора. Благодаря быстрому поглощению влаги NaOH, как и КОН, используется в твердом виде в качестве осушителей газов.
В большинстве органических растворителей NaOH нерастворим,
tпл=322 оС; tкип=1390 оС. В зависимости от температуры он кристаллизуется с различным содержанием кристаллизационной воды, а выше 61,8 оС – безводный. Водный раствор NаOH – сильное основание (щелочь).
Гидроксид натрия является важным продуктом химической и фармацевтической промышленности, используется для получения лекарств, солей (Na2CO3;NaHCO3 и др.), в производстве мыла, моющих средств и для других целей.
Получают NaOH электролизом водного раствора хлорида натрия, или известковым методом:
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3¯
Из-за плохой растворимости CaCO3, равновесие смещается в сторону образования NaOH, называемого, согласно способу получения, каустической содой.
KOH - гидроксид калия (едкое кали) - это белая, гигроскопичная кисталлическая масса, хорошо растворяется в воде с сильным разогреванием, tпл.= З60°С; tкип.= 1327 °С. Многие свойства КОН такие же как у NaOH. Его применяют для получения солей, жидких мыл, моющих средств.
Соли щелочных металлов
| 


 2Na2O
2Na2O