 |
Молекулярность и порядок реакции
|
|
|
|
Число молекул, принимающих участие в элементарном акте химической реакции, называется молекулярностью. При этом число молекул образующихся веществ не имеет значения, так как молекулярность определяется только числом молекул реагирующих веществ. Различают реакции:
● мономолекулярные, в которых только один вид молекул претерпевает превращение, например термическая диссоциация газообразного йода
J2  2J;
2J;
● бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида, например разложение йодистого водорода
2HJ → H2 + J2;
● тримолекулярные, в которых участвуют три молекулы одного или разных видов, например, взаимодействие окиси азота с водородом
2NO + H2 → N2O + H2O.
Вероятность одновременного соударения многих частиц очень мала, поэтому тримолекулярные реакции очень редки, а четырехмолекулярные вообще неизвестны. Уравнение (3.4), связывающее скорость реакции с концентрациями реагирующих веществ, называется кинетическим уравнением реакции. Порядок реакции n определяется суммой показателей степеней при концентрациях в кинетическом уравнении реакции 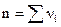 . Поскольку уравнение химической реакции фиксирует конечное и исходное состояния системы, значение молекулярности не всегда совпадает с общим порядком реакции. Объясняется это тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, через ряд последовательных промежуточных стадий. При этом скорость реакции, ее кинетика, определяются наиболее медленной стадией.
. Поскольку уравнение химической реакции фиксирует конечное и исходное состояния системы, значение молекулярности не всегда совпадает с общим порядком реакции. Объясняется это тем, что стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, через ряд последовательных промежуточных стадий. При этом скорость реакции, ее кинетика, определяются наиболее медленной стадией.
Порядок и молекулярность реакции могут не совпадать и в тех случаях, когда по условиям эксперимента различие концентраций реагентов весьма велико. Так, в реакции гидратации уксусного ангидрида
|
|
|
(СН3СО)2О + Н2О = 2СН3СООН,
протекающей при большом избытке воды, можно считать ее концентрацию постоянной 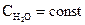 , тогда порядок этой бимолекулярной реакции будет равен единице. Подобные реакции называются псевдомономолекулярными. Можно сказать, что порядок и молекулярность реакции будут совпадать лишь для простых (элементарных) реакций, протекающих в одну стадию в соответствии со стехиометрическим уравнением.
, тогда порядок этой бимолекулярной реакции будет равен единице. Подобные реакции называются псевдомономолекулярными. Можно сказать, что порядок и молекулярность реакции будут совпадать лишь для простых (элементарных) реакций, протекающих в одну стадию в соответствии со стехиометрическим уравнением.
Односторонние реакции первого порядка. К ним относятся реакции термического разложения, реакции радиоактивного распада и многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной. Дифференциальное кинетическое уравнение односторонней реакции первого порядка имеет вид
 или
или 
Интегральное кинетическое уравнение получим после интегрирования:
lnс = -k1τ + const.(3.5)
Выражение (3.5) является уравнением прямой в системе координат lnc−τ, а k1 – тангенсом угла наклона этой прямой к оси τ. Значение const определяется из начальных условий: при τ = 0, c = c0 и lnc = lnc0. Тогда lnс = - k1τ + lnc0 или
k1 = 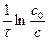 ,
,
где c0 – начальная концентрация реагирующего вещества; с – концентрация этого вещества к моменту времени τ от начала реакции. Если обозначить через 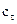 = c0 – cизменение концентрации исходного вещества к моменту времени τ от начала реакции, то
= c0 – cизменение концентрации исходного вещества к моменту времени τ от начала реакции, то
 . (3.6)
. (3.6)
Из уравнения (3.6) следует, что размерность константы скорости для реакции первого порядка k1 обратна размерности времени [время-1].
Односторонние реакции второго и третьего порядка. Дифференциальные кинетические уравнения реакций второго и третьего порядка соответственно имеют вид (при условии 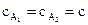 или
или 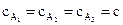 ):
):
 и
и 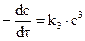 . (3.7)
. (3.7)
После интегрирования имеем:
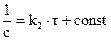 ;
; 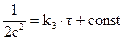
или
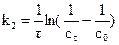 ;
;  . (3.8)
. (3.8)
Размерность k2определяется величиной, обратной концентрации и времени, т.е. [  c-1], размерность k3 определяется величиной, обратной времени и квадрату концентрации [τ--1-∙c-2].
c-1], размерность k3 определяется величиной, обратной времени и квадрату концентрации [τ--1-∙c-2].
|
|
|
Порядок реакции может быть определен графическим методом, который основан на том, что определяют такую функцию от концентрации, которая на графике зависимости ее от времени дает прямую линию. Для реакции первого порядка такой функцией является lnc; для реакции второго порядка  ; для реакции третьего порядка
; для реакции третьего порядка 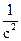 (рис. 3.1). Тангенс угла наклона этих прямых k оси τопределяет константу скорости соответствующей реакции.
(рис. 3.1). Тангенс угла наклона этих прямых k оси τопределяет константу скорости соответствующей реакции.

Рис. 3.1
|
|
|


