 |
Методом измерения электропроводности
|
|
|
|
Цель работы − определение теплоты растворения труднорастворимой соли.
Ддя расчета теплоты растворения труднорастворимых соединений может быть использовано уравнение Вант−Гоффа (2.7). Если значения констант равновесия выразить через произведения растворимости (ПР) при двух температурах, получим
 .(2.18)
.(2.18)
Для расчета ПР необходимо знать концентрацию ионов над осадком или растворимость осадка. Для равновесия в растворе соли, распадающейся на два иона:
 .
.
Растворимость 
и ПР = S2.
Для определения растворимости можно использовать метод измерения электропроводности, учитывая, что растворимость (концентрация насыщенного раствора) связана с удельной и эквивалентной электропроводностью соотношением
 ,
,
где S− растворимость данного вещества; æ− удельная электропроводность его насыщенного раствора; λ − эквивалентная электропроводность этого раствора.
Обычно для труднорастворимых электролитов насыщенный раствор бывает настолько разбавленным, что λ при данной концентрации мало отличается от электропроводности при бесконечном разбавлении λ∞. Величину λ∞ можно вычислить из подвижностей отдельных ионов электролита:
 .
.
Таким образом, зная величину λ∞ и определяя из опыта χ, можно рассчитать растворимость по уравнению
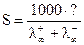 .
.
При этом следует иметь в виду, что электропроводность таких разбавленных растворов невелика и соизмерима с электропроводностью воды. Поэтому величина χ вычисляется из разности
 ,
,
где  − удельная электропроводность исследуемого раствора;
− удельная электропроводность исследуемого раствора;  − удельная электропроводность воды, равная 1·10-6 Ом-1 см-1.
− удельная электропроводность воды, равная 1·10-6 Ом-1 см-1.
Для пересчета справочных данных по подвижностям ионов, которые приведены для T = 298 К, на величины, соответствующие температуре опыта, используют уравнение
|
|
|
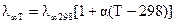 ,
,
где α− температурный коэффициент электропроводности, составляющий для солей величину 0,02-0,025.
Определивпри двух температурах растворимость Sи рассчитав  и
и  , по уравнению (2.14) можно найти теплоту растворения
, по уравнению (2.14) можно найти теплоту растворения  .
.
Оборудование
1. Коническая колба для растворения соли.
2. Воронка, бумажные фильтры.
3. Сосуд для измерения электропроводности.
4. Реохордный мост или кондуктометр.
5. Термостат.
Порядок выполнения работы
1. Небольшое количество труднорастворимой соли тщательно растереть в ступке и перенести в коническую колбу с притертой пробкой, промыть соль два-три раза дистиллированной водой для удаления легкорастворимых примесей.
2. Отмытую соль залить 100 мл дистиллированной воды и, плотно закрыв пробкой, непрерывно перемешивать в течение 20 мин. Полученной суспензии дать отстояться.
3. После отстаивания осадка часть раствора слить в сосуд для измерения электропроводности и измерить сопротивление раствора  при комнатной температуре.
при комнатной температуре.
4. Оставшийся раствор с осадком поместить в термостат и выдержать в нем не менее 20 мин, при температуре Т2 = 40°С.
5. Часть горячего раствора слить в сосуд для измерения электропроводности и измерить сопротивление раствора  .
.
6. Рассчитать растворимость соли Sпри температурах Т1и Т2, полагая, что æ р-ра =  .
.
7. Определить величины произведения растворимости  и
и  .
.
8. Рассчитать  .
.
Работа № 24. ИЗУЧЕНИЕ ТЕРМОДИНАМИКИ ПРОЦЕССА АДСОРБЦИИ
Цель работы – изучение адсорбционных процессов на примере влияния концентрации адсорбата на адсорбционные свойства адсорбента. Изучение влияния концентрации уксусной кислоты на ее адсорбцию активированным углем, графический расчет константы адсорбционного равновесия, расчет теплоты адсорбции.
|
|
|
Оборудование
1. Термостат.
2. Четыре колбы на 250 мл каждая.
3. Четыре конические колбы для титрования.
4. Воронки, фильтровальная бумага.
5. Бюретка.
Порядок выполнения работы
Работу выполняют две пары студентов. Измерения проводят при комнатной температуре и при 40°С. Полученные каждой парой студентов результаты используются для расчетов теплоты адсорбции Hадс.
1. В четыре колбы налить по 25 мл растворов уксусной кислоты различных концентраций и внести в них по 0,5 г активированного угля, предварительно измельченного в ступке. Интенсивно взболтать содержимое колб и выдержать для достижения равновесия в течение 30 мин., постоянно помешивая растворы (для опыта при повышенной температуре использовать термостат).
2. Растворы с углем отфильтровать.
3. От каждого фильтрата отобрать пипеткой по 10 мл раствора в колбы для титрования.
4. Пробы титровать раствором NaOHизвестной концентрацией Nщс индикатором фенолфталеин, предварительно внеся его по три капли на каждую пробу. Титрующий раствор прибавлять по каплям до появления устойчивой светло-розовой окраски.
5. По результатам титрования рассчитать равновесную концентрацию уксусной кислоты, установившуюся после адсорбции:
 .
.
6. Занести рассчитанные величины в таблицу.
7. По разности исходной и равновесной концентраций рассчитать величину адсорбции как число грамм-эквивалентов кислоты, поглощенной 1г угля:
 ,
,
где Сисх − исходная концентрация кислоты, г-экв/л; Сравн −равновесная концентрация кислоты, г-экв/л; Vр-ра −объем раствора кислоты, взятой для адсорбции, л; m− масса активированного угля, г.
8. По полученным данным построить изотерму адсорбции Г = f(Сравн)и линеаризованную изотерму  для обеих температур.
для обеих температур.
9. Рассчитать графически Г∞ и Кадс .
10.По величинам констант адсорбции при двух температурах рассчитать теплоту адсорбцииΔHадс по уравнению Вант-Гоффа:
 ,
,
где R = 8,314 Дж/моль∙К.
Таблица
| Номер раствора | Т, К | Концентрация СН3СOOН, г-экв/л | Г, г-экв/л |  г/л
г/л
| Кад с | ΔHадс | |
| Исходная Сисх | Равновесная Сравн | ||||||
|
|
|


