 |
Механизм токсичности летучих ядов
|
|
|
|
Фармацевтический факультет
__________________________
Кафедра фармацевтической химии и фармакогнозии
ХИМИКО-ТОКСИКОЛОГИЧЕСКОЕ ОПРЕДЕЛЕНИЕ КСЕНОБИОТИКОВ.
ЛЕТУЧИЕ ЯДЫ.
Методические указания к лабораторно-практическому занятию
по токсикологической химии для студентов IV курса
фармацевтического факультета
Нижний Новгород
ВВЕДЕНИЕ
«Летучие яды» - класс токсичных жидкостей органических веществ высокой липофильности и летучести. К группе летучих ядов относятся органического вещества с низкой температурой фазового перехода жидкость – пар; изолируемые из биологического материала методом перегонки с водяным паром и методом количественного определения – газовой или газожидкостной хроматографией.
Главными органами – мишенями для ядов данного класса, является центральная нервная система, печень и почки.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Классы летучих ядов различной химической природы:
1) алифатические углеводороды и их галогенопроизводные (хлороформ; хлоралгидрат; четыреххлористый углерод; дихлорэтан; 1,1,1-трихлорэтан; трихлорэтилен; тетрахлорэтилен; метиленхолорид и др.);
2) циклические алканы и их галогенопроизводные (гексан, гексахлороциклогексан и др);
3) кетоны (ацетон и др);
4) карбоновые кислоты (муравьиная, уксусная кислоты и др.);
5) ароматические соединения (бензол; хлорзамещенные производные бензола; нитробензол; толуол; этилбензол и др.);
6) фенолы (фенол; крезолы; пентахлорфенол; хлорофенолы и др.);
7) простые газообразные вещества (хлор Cl2, фтор F2 и др.);
8) летучие оксиды и гидриды (угарный газ СО, диоксид азота NO2, фтороводород HF, сероводородH2S, селеноводород H2Se, арсин AsH3, фосфин PH3 и др.);
|
|
|
9) цианид водорода HCN;
10) акрилонитрил CH2=CHCN;
11) ацетонитрил CH3CN;
12) диметилформамид HCON(CH3)2.
Как известно, биологический материал часто подвергается консервированию. Некоторые консерванты, а также стабилизаторы, растворители, аэрозольные пропелленты в лекарственных формах представляют собой «летучие» яды:
Аэрозоли фторуглеводороды - трифторметан, дихлорфторметан.
Ингаляторы инертные газы.
Инъекционные растворы пропиленгликоль, этилолеат, бензилбензоат, фенол, крезол, хлорбутанол, бензиловый спирт.
Свечи пропиленгликоль.
Летучие яды легко абсорбируются через легкие, кожу и желудочно-кишечный тракт. Липофильность растворителей возрастает с увеличением молярной массы, а летучесть при этом уменьшается.
Большинство растворителей представляют собой не индивидуальные вещества, а смесь химических соединений. Сведения о комбинированной токсичности летучих ядов весьма ограничена. Как и для других классов токсикантов, комбинированные воздействия летучих ядов могут быть аддитивны, синергитические или антагонистические. Несмотря на различную степень опасности, все летучие яды дают токсические эффекты.
ТОКСИКОДИНАМИКА И ТОКСИКОКИНЕТИКА ЛЕТУЧИХ ЯДОВ
Токсикодинамика и токсикокинетика летучих ядов устанавливают связь между дозой, скоростью и механизмами при абсорбции, распределении и выведении летучего яда.
Абсорбция
Всасывание паров летучего соединения происходит преимущественно в альвеолах, хотя отчасти абсорбция начинается в верхних отделах дыхательных путей. Практически сразу устанавливается равновесие между молекулами газообразного соединения в альвеолярном воздухе и крови капилляров легких. Коэффициент распределения может быть определен как отношение концентраций летучего вещества между указанными средами в состоянии равновесия:

Распределение
|
|
|
Растворители, всасывающиеся из желудочно-кишечного тракта в систему портальной вены, попадают в печень и выделяются с желчью. Они могут также элиминироваться органами дыхания. Константа скорости печеночной элиминации зависит от количества токсиканта, а элиминация через легкие напротив, не зависит от концентрации растворителя в крови.
Скорость переноса летучих ядов зависит от скорости артериального кровотока и коэффициента распределения растворителя в системе ткань – кровь.
Механизм токсичности летучих ядов
Как упоминалось выше, поражение летучими ядами в первую очередь происходит в легких. Основным органом-мишенью для паров летучих органических растворителей является центральная нервная система (ЦНС). Однако, все представители данной группы имеют некоторые особенности.
ИЗОЛЯЦИЯ ЛЕТУЧИХ ЯДОВ ИЗ БИОМАТЕРИАЛА.
МЕТОД ДИСТИЛЛЯЦИИ С ВОДЯНЫМ ПАРОМ
Дистилляция с водяным паром широко применяется как в лабораторной практике, так и в химической промышленности для получения веществ в чистом виде. В ХТА данным методом достигается изолирование ядовитых и сильнодействующих веществ из объектов исследования биологической природы. Особенно удобно изолировать дистилляцией с водяным паром вещества, труднорастворимые или практически нерастворимые в воде. При нагревании двухкомпонентной смеси, состоящей из практически нерастворимых друг в друге веществ, каждое из них увеличивает упругость своих паров независимо от другого. Когда упругость паров смеси достигает атмосферного давления (точнее, превышает его на бесконечно малую величину), смесь закипает и оба вещества начинают перегоняться. Так как сумма упругости паров обоих веществ равна атмосферному давлению, температура перегонки каждого вещества в смеси будет ниже температуры кипения каждого компонента в чистом виде (рис.1). Температура кипения чистой жидкостей и их смеси соответствует точкам пересечения изобары с кривыми давления пара.
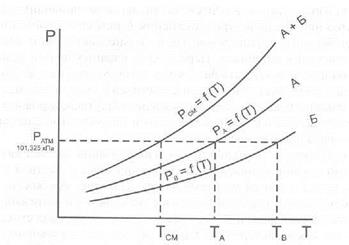
Рис.1. Диаграмма состояния (Р-Т) для двух несмешивающихся жидкостей (А и Б) и их смеси.
Дистилляция с водяным паром особенно выгодна, когда изолируемое вещество кипит при очень высокой температуре или разлагается при температуре кипения.
|
|
|
Связь между летучестью и молекулярным весом для веществ, нерастворимых друг в друге, выражается уравнением:

где W0 и WW – вес органического вещества и воды в дистилляте;
М0 и МW – соответствующие молекулярные веса;
Р0 и РW - упругости паров.
В ряде случаев летучими с водяным паром оказываются вещества, растворимые в воде в том или ином соотношении. Для веществ, которые растворимы в воде, а вода оказывает влияние на упругость их паров, как, например, кислоты, фенолы, амины, также имеются свои закономерности. Более летучими с водяным паром являются вещества с большим молекулярным весом и более высокой температурой кипения, чем низшие члены гомологического ряда. Для многих органических веществ способность их перегоняться с водяным паром может быть объяснена образованием нераздельно кипящих (азеотропных) смесей их с водой.
Азеотропная – смесь двух жидкостей, состав которой не изменяется при дистилляции.
КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Синильная кислота
Для качественного определения синильной кислоты в химико-токсикологическом анализе имеет значение только реакция образования берлинской лазури.
NaOH + HCN = NaCN + H2O;
FeSO4 + 2NaCN = Fe(CN)2 + Na2SO4;
Fe(CN)2 + 4NaCN = Na4[Fe(CN)6];
3Na4[Fe(CN)6] + 2Fe2(SO4)3 = Fe4[Fe(CN)6]3 + 6Na2SO4
Чувствительность реакции 20 мкг HCN в 1 мл раствора. Открываемый минимум 20 мкг при предельном разбавлении 1:100000. При содержании 20-30 мкг HCN в пробе образуется соответственно зеленое или голубое окрашивание раствора, а при количествах, больших 30мкг, выделяется характерный синий осадок берлинской лазури, который может быть предъявлен в качестве доказательства обоснованности заключения об обнаружении синильной кислоты.
Реакция специфична и имеет положительное судебно-химическое значение.
Хлороформ
Качественное определение хлороформа осуществляется с помощью ряда реакций.
1. Реакция отщепления галоида.
Эта реакция является общей реакцией на галогенпроизводные.

Отщепление галоида достигается нагреванием части дистиллята со спиртовым раствором едкой щелочи. Хлорид-ион обнаруживается реакцией с раствором нитрата серебра в азотнокислой среде. Образование мути или осадка говорит о наличии галогенпроизводных и необходимости проведения других реакций их обнаружения. Реакция не специфична.
|
|
|
2. Реакция образования изонитрила.
В случае отсутствия осадка или мути в реакции №1, учитывая ее сравнительно невысокую чувствительность, нужно проделать реакцию получения изонитрила.
CHCl3+3NaOH(спирт. р-р)+C6H5NH2 = C6H5N=C+3NaCl+3H2O
Отрицательный результат этой сравнительно чувствительной реакции (0,01 мг) позволяет судить о ненахождении в исследуемом объекте этих веществ. При положительном результате проводят другие реакции.
Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана.
3. Реакция с резорцином в щелочной среде.

Появление розового или красного окрашивания в исследуемой пробе может указывать на наличие хлороформа. Параллельно выполняется «слепой» опыт, цель которого исключить ошибки за счет продуктов окисления резорцина, окрашенных в зеленый цвет и маскирующих розовое окрашивание.
Реакция не специфична, ее дают все хлорпроизводные, кроме дихлорэтана, а также формальдегид.
4. Реакция с реактивом Фелинга.
При значительных количествах хлороформа проводят реакцию восстановления Cu(OH)2 в Cu2(OH)2, переходящую далее в Cu2O при кипячении с реактивом Фелинга. При наличии хлороформа образуется желтый осадок гидрата закиси меди, переходящий в красный осадок закиси меди.

Реакция не специфична, ее дает хлороформ, хлоралгидрат и формальдегид. Не дают четыреххлористый углерод и дихлорэтан.
5. Реакция Фудживара.
Реакция взаимодействия с пиридином в присутствии щелочи. На этой реакции основано предварительное обнаружение галогенпроизводных в моче.

О наличии хлороформа судят по появлению красной окраски. Реакция не специфична, ее дают все хлорпроизводные.
Хлоралгидрат
Хлоралгидрат дает все реакции, которые используют для обнаружения хлороформа (см. реакции 1-5), т.к. они проводятся в присутствии щелочи, под влиянием которой хлоралгидрат разлагается с выделением хлороформа:

Для отличия хлоралгидрата от хлороформа используются специальные пробы.
1. Реакция с реактивом Несслера. В реакции используются восстановительные свойства хлоралгидрата. В результате образуется сначала кирпично-красный осадок, который постепенно меняет окраску до грязно-зеленого цвета.

Другие хлорпроизводные этой реакции не дают, однако она не специфична, т.к. ее дают альдегиды и другие восстановители.
2. Экстракция из дистиллята.
Дистиллят повторно извлекают небольшими порциями эфира и фильтруют через сухой фильтр. Следы остатка после удаления эфира при комнатной температуре обрабатывают несколькими каплями воды и с раствором проводят реакции 1-5. Хлороформ при такой обработке улетучится, и положительные результаты реакций укажут на наличие хлоралгидрата.
|
|
|
Четыреххлористый углерод
Качественное обнаружение четыреххлористого углерода основано на тех же реакциях, что и обнаружение хлороформа и хлоралгидрата: реакции отщепления хлора, реакции образования изонитрила, получение розового окрашивания с резорцином в щелочной среде. Однако в отличие от хлороформа и хлоралгидрата четыреххлористый углерод не дает реакции с реактивом Феллинга, т.к. в процессе нагревания с раствором щелочи не образуется веществ, обладающих восстановительными свойствами.
Заключение о наличии четыреххлористого углерода в дистилляте делают при положительном результате реакций 1-3 и отсутствии результата реакции с реактивом Фелинга.
|
|
|


