 |
Элементы подгруппы углерода могут в соединениях проявлять как положительную, так и отрицательную степень окисления.
|
|
|
|
Положительную степень окисления они проявляют при взаимодействии с более электроотрицательными атомами, чем сами, выступают в роли восстановителей и отдают другим атомам с внешнего слоя свои неспаренные электроны. Величина степени окисления при этом равна +2 в невозбужденном состоянии или +4 в возбужденном состоянии. Причем степень окисления +2 для элементов, стоящих в начале группы (C, Si, Ge), мало характерна. Такие их соединения малочисленны, неустойчивы и в момент образования легко превращаются в соединения со степенью окисления +4. Однако для элементов, стоящих в конце группы, устойчивость таких соединений повышается и они (например, для Pb, Sn) легко могут быть получены.
Отрицательную степень окисления элементы подгруппы углерода проявляют при взаимодействии с атомами менее электроотрицательных элементов, чем сами. В этом случае они выступают в роли окислителей и забирают от других атомов 4 недостающих до завершения своего внешнего слоя электрона. Величина степени окисления при этом равна –4.
С водородом элементы подгруппы углерода образуют соединения общего вида RH4. Это газообразные вещества, плохо растворимые в Н2О. Их водные растворы не обладают ни кислотными, ни основными свойствами. Устойчивость водородных соединений в группе сверху вниз резко уменьшается. Уже силан (SiH4) при обычных условиях самопроизвольно воспламеняется, а PbH4 выделить не удается.
Элементы подгруппы углерода образуют с кислородом оксиды общей формулы 
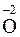 и
и 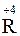
 . Оксиды RO для элементов, стоящих в начале группы (С и Si), являются несолеобразующими, а для остальных элементов группы – амфотерными с постепенным нарастанием основных свойств. Так, у GeO преобладают кислотные свойства, а у PbO – основные.
. Оксиды RO для элементов, стоящих в начале группы (С и Si), являются несолеобразующими, а для остальных элементов группы – амфотерными с постепенным нарастанием основных свойств. Так, у GeO преобладают кислотные свойства, а у PbO – основные.
|
|
|
Оксиды RO2 обладают кислотными свойствами, им соответствуют кислоты вида H2RO3. Сила этих кислот в группе сверху вниз убывает, что объясняется увеличением в той же последовательности у ее элементов металлических свойств. Причем чисто кислотными свойствами обладают только данные оксиды и гидроксиды углерода, кремния и германия. Для всех остальных элементов группы (Sn, Pb) гидраты их высших оксидов и сами эти оксиды являются уже амфотерными соединениями.
В IVA группе закономерно изменяются физические свойства и реакционная способность простых веществ, образованных ее элементами. Так, сверху вниз (табл. 16) увеличиваются их плотность, восстановительная способность, металлические свойства. Косвенным подтверждением этому служит уменьшение в этом же направлении температуры плавления простых веществ.
Углерод и кремний являются типичными неметаллами, их простые вещества имеют атомную кристаллическую решетку, образованную ковалентными неполярными связями, и, как следствие этого – высокую температуру плавления.
При переходе от германия к олову происходит резкое изменение природы атомных связей в кристаллах простых веществ от ковалентных с небольшой примесью металлических (германий), к чисто металлическим (олово, свинец). Металлическая связь в олове и свинце ввиду больших размеров атомов сравнительно слабая, поэтому значения температуры плавления их простых веществ небольшие.
Следует отметить, что металлические свойства простых веществ элементов IVA группы выражены сильнее, чем у ранее изученных простых веществ галогенов, халькогенов и пниктогенов. По сравнению с ними простые вещества IVA группы являются более слабыми окислителями, а гидраты их высших оксидов обладают более слабыми кислотными свойствами.
|
|
|


