 |
Решение Задачи 9-3 (авторы: Медведев И. Н., Долженко В. Д.)
|
|
|
|
1) После первых двух опытов нетронутым осталось вещество А массой 0,6005 г. Далее его сожгли и получили газообразный оксид Е, количество которого равно 1,12 / 22,4 = 0,05 моль. Пусть он содержит два атома А в молекуле, тогда количество А равно 0,1 моль и
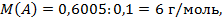
то есть близко к литию. Но литий газообразных оксидов не образует (к тому же, он растворился бы в предыдущих опытах).
Значит, в молекуле Е один атом А. Тогда количество А равно 0,05 моль и
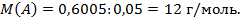
Тогда это углерод и углекислый газ. Итак, А – это С, Е – это СО2.
Значит, в задаче идёт речь об элементах подгруппы углерода.
Раствор 1 не содержит А и Б, значит в нём содержится только нитрат элемента В (так как раствор получен растворением В в азотной кислоте). Причём азотная кислота в такой концентрации окисляет элементы группы углерода только до степени окисления +2. В опыте 4 этот нитрат выделили из раствора и растворили в воде. После этого с помощью сульфида калия был осаждён, вероятно, сульфид. Тогда З имеет формулу В S (степень окисления равна +2). Если атомная масса В равна х, то массовая доля В в соединении З равна
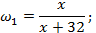
а поскольку масса З равна 3,5890 г, то масса простого вещества В равна

Оставшиеся элементы подгруппы углерода при растворении в концентрированной щёлочи окисляются до соединений со степенью окисления +4. Значит, при добавлении кислоты в опыте 5 выпадает гидратированный оксид вида Б О2· n H2O. Он при прокаливании даст оксид Б О2 (он же вещество И). Пусть молярная масса Б равна y. Тогда, аналогично предыдущим рассуждениям, исходя из того, что масса И равна 2,1030 г, масса Б равна
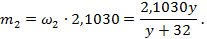
Так как масса исходной смеси равна 4,6915 г, а масса углерода равна 0,6005 г, то



Рассмотрим все возможные варианты:
Если Б – это свинец, то у = 207,2, тогда х = 55, то есть марганец. Но он находится не в группе углерода.
|
|
|
Если Б – это олово, то у = 118,71, тогда х = 67,5, то есть между галлием и цинком. Но ни тот, ни другой не располагаются в группе углерода.
Если Б – это германий, то у = 72,61, тогда х = 88, то есть стронций. Он тоже не в группе углерода.
Если Б – это кремний, то у = 28,09, тогда х = 207, то есть свинец.
Число рассматриваемых вариантов можно сократить, если знать, что в щёлочи растворяются только кремний и олово, а чёрный сульфид образует свинец.
Значит, Б – это Si, В – это Pb, И – это SiO2, З – это PbS.
Газ Г – один из оксидов азота, которые обычно выделяются при реакциях металлов с азотной кислотой. Молярная масса Г при этом равна 14,88·2,02=30 г/моль. Из всех оксидов азота такую молярную массу имеет только NO. Г – это NO.
При реакции кремния с концентрированной щёлочью образуется водород. Значит, газ Д – это H2.
Ж кристаллизовалось из раствора, полученного пропусканием через щёлочь углекислого газа. Значит, это карбонат натрия. Но массовая доля кислорода в Ж равна 72,68 % (в безводном карбонате – 45,28 %). Значит, это кристаллогидрат вида Na2CO3·nH2O. Массовую долю кислорода в нём можно выразить:

Значит, Ж – это Na2CO3·10H2O.
2) Уравнения реакций
1. 3 Pb + 8 HNO3 = 3 Pb(NO3)2 + 2 NO↑ + 4 H2О
2. Si + 2NaOH + H2O = Na2SiO3 + 2 H2
3. C + O2 = CO2
4. CO2 + 2 NaOH + 9 H2O = Na2CO3·10H2O
5. Pb(NO3)2 + K2S = 2 KNO3 + PbS↓
6. Na2SiO3 + 2 HCl + (n–1) H2O = SiO2·nH2O↓ + 2 NaCl
7. SiO2·nH2O = SiO2 + n H2O
3) Массы углерода и свинца рассчитаны ранее. Теперь довольно легко найти массовые доли веществ в исходной смеси:

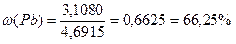
ω(Si) = 100 % – 12,80 % – 66,25 % = 20,95 %
Количество выделенного из раствора гидрата карбоната натрия:

Т. к. на 1 формульную единицу Na2CO3·10H2O приходится 1 моль углерода, максимальное количество Na2CO3·10H2O равно исходному количеству моль углерода, т. е. 0,05 моль.
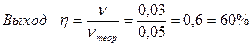
Система оценивания:
| 1. | Определение веществ А– И по 0,5 балла | |
| Расчёты NO, CO2, PbS, SiO2, Na2CO3·10H2O по 1 баллу | 9,5 баллов | |
| 2. | Уравнения реакций по 1 баллу | 7 баллов |
| 3. | Расчёт массовых долей веществ в исходной смеси – 2,5 балла (верные массовые доли для любых 2-х по 1 баллу, третий – 0,5 балла) Расчёт выхода Na2CO3·10H2O – 1 балл | 3,5 балла |
| ИТОГО: | 20 баллов |
|
|
|
Задача 9-4. Неизвестный порошок вещества Х1 жёлтого цвета состоит из двух химических элементов. При растворении Х1 в большом избытке концентрированной азотной кислоты выделяется бурый газ Х2 и образуется бесцветный раствор (реакция 1). При действии на этот раствор небольшого избытка водного раствора хлорида бария выпадает белый кристаллический осадок Х3 (реакция 2). К фильтрату, полученному при отделении осадка Х3, добавляют избыток раствора нитрата серебра. При этом наблюдается выпадение белого творожистого осадка Х4 (реакция 3). К раствору, оставшемуся после отделения осадка Х4, по каплям осторожно добавляют водный раствор гидроксида натрия до полного осаждения жёлтого осадка Х5 (реакции 4 и 5). Определите неизвестные вещества и запишите уравнения реакций (пять уравнений), предполагая, что все реакции протекают количественно, причём масса Х5 в 1,39 раз меньше, чем масса Х3.
|
|
|


