 |
Решение Задачи 10-2 (авторы: Медведев И. Н., Долженко В. Д.)
|
|
|
|
1) В опыте 1 одно из трёх простых веществ В не растворилось в щёлочи.
В опыте 2 получен раствор нитрата В с непрореагировавшим избытком азотной кислоты (раствор 2). После упаривания раствора (опыт 3) удалили избыток азотной кислоты, твёрдый остаток растворили в воде при этом в растворе содержится только нитрат. Из него при реакции с сульфидом калия выпадает чёрный осадок Е, вероятно, сульфида В. Пусть Е имеет формулу В 2Sn. Тогда, исходя из того, что нам известны массы исходного В (0,5180 г) и получившегося Е (0,5982 г), можно определить массовую долю В в сульфиде:
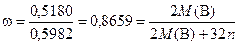
Значит М (В) = 103,3· n, где n принимает целые значения. Тогда для различных n получаем варианты:
n = 1. M (В) =103,3 – близко к родию, но в условиях реакции образование сульфида Rh(I) невозможно.
n = 2. M(В) =206,6 – близко к свинцу. Свинец имеет чёрный нерастворимый сульфид PbS.
n = 3 и выше – М(В) больше 300, таких элементов нет.
Значит, В – Pb, Е – PbS. Свинец находится в 14 группе. В силу того, что углерод нерастворим в щёлочи, возможные кандидаты на оставшиеся простые вещества – это кремний, германий и олово.
В опыте 4 при нейтрализации образуется смесь гидратированных оксидов, один из которых по условию задачи растворяется в концентрированной соляной кислоте. Прокаливание оставшегося гидратированного оксида должно приводить к обезвоживанию и образованию оксида вида АО2. Его масса равна 0,1803г, значит 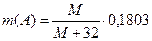 М – молярная масса А.
М – молярная масса А.
В опыте 5 описано получение сульфида Б. Его масса равна 0,1828 г. Значит, 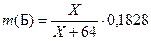 , где Х – молярная масса Б. Нам также известна общая масса А и Б в исходной навеске: она равна 0,7210 – 0,5180=0,2030 г. Получаем:
, где Х – молярная масса Б. Нам также известна общая масса А и Б в исходной навеске: она равна 0,7210 – 0,5180=0,2030 г. Получаем:
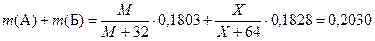 ,
,
Значит М и Х связаны соотношением: 
Теперь можно рассмотреть три случая:
Если Б – это кремний, то Х = 28,09, тогда М = 142,52. Элементов с такой массой в группе углерода нет. Значит, Б – не кремний.
Если Б – это германий, то Х = 72,61, тогда М = 45,49. Элементов с такой массой в этой группе тоже нет. Значит, Б – не германий.
Если Б – это олово, то Х = 118,71, тогда М = 28,06. Значит, A и Б – это Sn и Si. (в любом порядке), вещества: И – это SiO2, К – это SnS2.
Бесцветный, лёгкий газ Г, образующийся при растворении кремния и олова в концентрированном растворе щёлочи, это H2.
Найдём молярную массу газа Д:
|
|
|
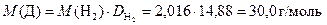
Из всех существующих оксидов азота, один из которых должен выделяться в ходе реакции свинца с азотной кислотой, такую молярную массу имеет только оксид азота (II). Следовательно Д – это NO.
При отжиге на воздухе сульфида свинца (Е) образуется газ Ж и твёрдое оранжевое вещество З. Значит, газ Ж – это SO2. А З – это один из оксидов свинца – либо PbO, либо Pb3O4. Массовая доля свинца в З равна 0,5180:0,5713=0,9067, что соответствует массовой доле свинца в Pb3O4. Значит, З – это Pb3O4.
2) Уравнения реакций:
1. Si + 2NaOH + H2O → Na2SiO3 + 2H2;
2. Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑;
3. 3Pb + 8HNO3 → 3Pb(NO3)2 + 2NO↑ + 4H2O;
4. Pb(NO3)2 + K2S → 2KNO3 + PbS↓;
5. 3PbS + 5O2 → Pb3O4 + 3SO2;
6. Na2SiO3 + 2HCl + (n – 1)H2O → SiO2·nH2O↓ + 2NaCl;
7. Na2[Sn(OH)6] + 2HCl + (n – 4)H2O → SnO2· n H2O↓ + 2NaCl;
8. SnO2· n H2O + 6HCl → H2[SnCl6] + (n + 2)H2O;
9. SiO2· n H2O → SiO2 + n H2O;
10. H2[SnCl6] + 2H2S → SnS2↓ + 6HCl.
3) Масса свинца в навеске нам дана: она равна m 1 => 0,5180 г.
Масса SiO2 равна 0,1803 г, значит, масса кремния равна
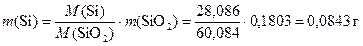
Масса SnS2 равна 0,1828 г, можно провести аналогичный расчёт для массы олова:
 или
или
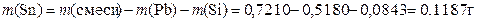
Массовые доли:
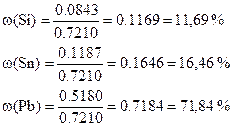
4) Состав вещества Y не исчерпывается указанными элементами, т. к. сумма их долей не равна 100 %. Найдём разницу: w = 100 – 2,506 – 56,459 – 23,564 – 3,053 – 3,955 = 10,463 %
Определим мольное отношение элементов, содержащихся в Y:
| Na | Pb | C | N | H | |
| w | 2,506 | 56,459 | 23,564 | 3,055 | 3,955 |
| M | 22,989 | 207,2 | 12,011 | 14,007 | 1,008 |
| n = w / M | 0,1090 | 0,2725 | 1,9619 | 0,2181 | 3,9236 |
| n / nNa | 1,0 | 2,5 | 18,0 | 2,0 | 36,0 |
Если привести к целым значениям, то Na: Pb: C: N: H = 2: 5: 36: 4: 72.
|
|
|
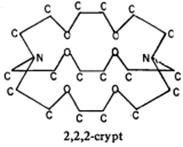 Молекула 2,2,2-crypt имеет формулу C18H36N2O6. Значит, Y содержит 2 молекулы 2,2,2-crypt. Соотношение C: N: H = 18:2:36, совпадает с таковым для 2,2,2-crypt, но молекула криптанда содержит ещё и кислород рассчитаем массовую долю кислорода в соедини Y исходя из состава 2,2,2-crypt:
Молекула 2,2,2-crypt имеет формулу C18H36N2O6. Значит, Y содержит 2 молекулы 2,2,2-crypt. Соотношение C: N: H = 18:2:36, совпадает с таковым для 2,2,2-crypt, но молекула криптанда содержит ещё и кислород рассчитаем массовую долю кислорода в соедини Y исходя из состава 2,2,2-crypt:
nO = 6·nNa = 0,6540 => w(O) = nO· MO = 10,464 %,
что совпадает с рассчитанным ранее остатком, т. е. состав Y выражается формулой Na2Pb5C36H72N4O12 [1] или Na2Pb5(2,2,2-crypt)2.
5) 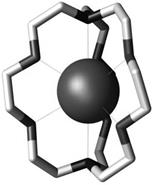 Из того факта, что на один атом натрия приходится одна молекула криптанда, а в состав аниона входят только атомы одного сорта, можно предположить образование комплексного катиона
Из того факта, что на один атом натрия приходится одна молекула криптанда, а в состав аниона входят только атомы одного сорта, можно предположить образование комплексного катиона
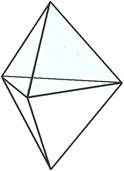 [Na(2,2,2-crypt)]+ и аниона Pb52–.
[Na(2,2,2-crypt)]+ и аниона Pb52–.
Согласно правилу октета свинец, который имеет 4 валентных электрона, может образовать 4 одинарные связи, наличие у аниона заряда «2–» говорит о том, что 2 атома из пяти смогут образовать только 3 связи. Таким образом, в анионе содержится 2 атома свинца с тремя связями Pb–Pb и 3 атома с четырьмя связями Pb–Pb, этому условию отвечает тригональная бипирамида.
Система оценивания:
| 1. | Определение веществ А– З по 0,5 балла | 4 балла |
| Расчёты PbS, SiO2, SnS2, Pb3O4 по 0,5 балла | 2 балла | |
| 2. | Уравнения реакций по 1 баллу | 10 баллов |
| 3. | Расчёт массовых долей элементов | 1 балла |
| Расчёт состава Y | 2 балла | |
| Строение аниона Pb52–.(0,5 балла), обоснование (0,5 балла) | 1 балл | |
| ИТОГО: | 20 баллов |
Задача 10-3. Газообразное при н. у. вещество А окисляется при нагревании на платино-родиевом катализаторе с образованием бесцветного газа Б (реакция 1), который мгновенно превращается на воздухе в газ В бурого цвета (реакция 2). При температуре ниже 135 °C часть молекул газа В попарно соединяется в димеры Г (реакция 3), причём чем ниже температура, тем менее интенсивной становится окраска газа. Уже при температуре 25 °C и давлении 1 атм. мольное соотношение Г/В в равновесной смеси составляет 2,16/1. Плотность такой смеси по воздуху равна 2,67. При охлаждении смеси B и Г ниже 21,1 °C она почти полностью обесцвечивается и превращается в неокрашенную жидкость, состоящую из молекул Г (иногда слегка желтоватую из-за примеси молекул В).
1. Вычислите мольные доли газов В и Г в равновесной смеси при температуре 25 °C и общем давлении 1 атм., а также константу равновесия димеризации В в этих условиях.
2. По данным, приведённым в условии задачи, рассчитайте молекулярную массу газа В. К какому классу реакций по знаку теплового эффекта (эндо- или экзотермическим) следует отнести реакцию димеризации В? Обоснуйте свой ответ.
|
|
|
При сжигании А в кислороде образуются только вода и газ Д (реакция 4), являющийся одним из основных компонентов воздуха. Водный раствор А окрашивает лакмусовую бумагу в синий цвет.
3. Приведите формулы и названия веществ А–Д, напишите уравнения реакций 1–4.
4. Нормальное атмосферное давление при 0 °C составляет 101,325 кПа. Рассчитайте парциальное давление газа Д в кПа в сухом воздухе в этих условиях.
Смесь веществ Б и В при охлаждении ниже −36 °C реагирует с образованием неустойчивой синей жидкости E (реакция 5). Для получения смеси Б и В нужного состава в лаборатории используют реакцию 50%-ного водного раствора кислоты Ж с крахмалом (С6Н12О5)n (реакция 6).
Для получения вещества З, использующегося как удобрение, в промышленности проводят реакцию между А и Ж (реакция 7). Нагревание З до 245 °C приводит к выделению газа И (реакция 8).
5. Напишите уравнения реакций 5–8, изобразите структурные формулы веществ Е–И.
|
|
|


