 |
Решение Задачи 11-4 (aвторы: Сальников О. Г., Ильин М. А.)
|
|
|
|
1. Получение Li[AlH4] осуществляют в безводных условиях, поскольку он реагирует с водой с выделением водорода:
Li[AlH4] + 4 H2O ® LiOH + Al(OH)3¯ + 4 H2
(или Li[AlH4] + 4 H2O ® Li[Al(OH)4] + 4 H2).
2. а) Концентрированная соляная кислота – это водный (~36–38 %) раствор хлороводорода. При взаимодействии металлического алюминия с соляной кислотой образуется раствор хлорида алюминия, из которого безводный AlCl3 закристаллизовать не удастся:
2 Al + 6 HCl ® 2 AlCl3 водн. + 3 H2.
б) При взаимодействии металлического алюминия с хлором образуется безводный хлорид алюминия: 2 Al + 3 Cl2 ® 2 AlCl3.
в) Попытка получить безводный AlCl3 при прокаливании кристаллогидрата AlCl3×6H2O окажется неудачной, поскольку будет протекать гидролиз:
AlCl3×6H2O  Al(OH)2Cl + 2 HCl + 4 H2O
Al(OH)2Cl + 2 HCl + 4 H2O
(или при более высокой температуре: AlCl3×6H2O  Al2O3 + 6 HCl + 9 H2O).
Al2O3 + 6 HCl + 9 H2O).
3. Рассмотрим верхнюю часть приведённой схемы превращений. Присоединение бромоводорода к алкенам в присутствии пероксида бензоила происходит по радикальному механизму против правила Марковникова, т. е. из пропена получается 1-бромопропан (A). При взаимодействии 1-бромопропана с нитритом серебра и цианидом калия происходит нуклеофильное замещение, в результате чего получаются 1-нитропропан (Б) и бутиронитрил (В). Гидролиз соединения В в кислой среде при нагревании даёт масляную кислоту (Г).

Алюмогидрид лития восстанавливает нитросоединения и нитрилы до первичных аминов, карбоновые кислоты – до первичных спиртов, а первичные алкилгалогениды – до алканов. Структурные формулы соединений I – IV:
 .
.
При действии трифторнадуксусной кислоты пропен окисляется до пропиленоксида (Д), который при восстановлении алюмогидридом лития даёт изопропанол (V). Окисление пропена перманганатом калия в кислой среде приводит к образованию уксусной кислоты (Е), которая при нагревании с этанолом в присутствии концентрированной серной кислоты превращается в этилацетат (Ж). Взаимодействие последнего с метиламином приводит к образованию N -метилацетамида (З). При восстановлении алюмогидридом лития этилацетат превращается в этанол (VI), а соединение З – в N- метил- N- этиламин (VII).
|
|
|
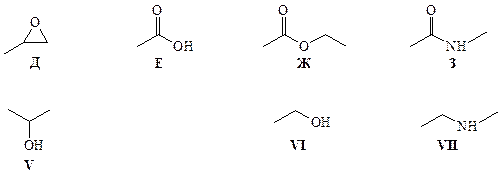
4. Уравнение реакции окисления пропена перманганатом калия в сернокислой среде:
H3C–CH=CH2 + 2 KMnO4 + 3 H2SO4 ® CH3COOH + CO2 + 2 MnSO4 + K2SO4 + 4 H2O.
Система оценивания:
| 1. | Уравнение реакции гидролиза Li[AlH4] | 1 балл |
| 2. | Возможность получения безводного AlCl3:
а) Al + HClконц. (уравнение реакции + пояснения) – 1 балл
б) Al + Cl2 (уравнение реакции + пояснения) – 1 балл
в) AlCl3×6H2O  (любое из уравнений реакции, в том числе без указания температуры + пояснения) –1 балл (любое из уравнений реакции, в том числе без указания температуры + пояснения) –1 балл
| 3 балла |
| 3. | Структурные формулы А–З и I–VII по 1 баллу Примечание: если участником Олимпиады на первой стадии (присоединение HBr в присутствии R2O2) в структуре А допущена ошибка (т. е. получен 2‑бромпропан вместо 1‑бромпропана), то структурная формула А оценивается в 0 баллов, а последующие стадии получения соединений Б–Г и I–IV (в случае полностью правильных дальнейших превращений функциональных групп в синтезе) оцениваются по 0.75 балла. | 15 баллов |
| 4. | Уравнение реакции окисления пропена Примечание: если в уравнении реакции нет стехиометрических коэффициентов, но указаны все реагенты и продукты – 0.5 балла; в иных вариантах (нет коэффициентов и указаны не все вещества-участники реакции) – ответ оценивается в 0 баллов. | 1 балл |
| ИТОГО: | 20 баллов |
 Задача 11-5. Равновесие изомеризации.
Задача 11-5. Равновесие изомеризации.
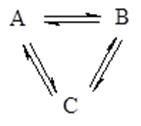
В реакции изомеризации, протекающей в газовой фазе, участвуют три изомера A, B и C. При некоторой температуре T в системе устанавливается равновесие:
Реакциям A ⇄ B, A ⇄ C и B ⇄ C соответствуют константы равновесия K1, K2 и K3.
|
|
|
Вопросы:
Выразите константы равновесия K1, K2 и K3 через равновесные мольные доли изомеров, содержащихся в смеси.
Сколько из этих констант равновесия (одна, две или три) необходимо для расчёта состава равновесной смеси в указанной системе? Объясните свой ответ.
Выведите формулы для расчёта равновесных мольных долей изомеров A, B и C в смеси через константы равновесия.
Изомер A нагревали при температуре 500 К до достижения равновесия. Выход изомера B составил 28 %, а изомера C 56 %. Рассчитайте значения констант K1, K2 и K3.
При 600 К стандартные энергии Гиббса образования трёх изомерных веществ A, B и C – н-пентана, изопентана (2-метилбутана) и неопентана (2,2-диметилпропана) равны 141, 138 и 145 кДж/моль соответственно. Рассчитайте значения констант равновесия K1, K2 и K3 и мольные доли изомерных пентанов в равновесной смеси.
Необходимые знания:
Стандартная энергия Гиббса образования вещества – изменение энергии Гиббса для реакции образования данного вещества из простых веществ при стандартных условиях. Обозначается ∆fG° (индекс f обозначает «formation» (образования), значок ° обозначает стандартные условия).
∆G° = −R·T·ln K, или  .
.
R = 8.314 Дж/(моль·К)
|
|
|


