 |
Принцип действия свинцово-кислотного аккумулятора
|
|
|
|
ГЛАВА II
ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
Источники электрической энергии в бронетанковой технике обычно классифицируют на первичные (генератор с реле-регулятором), и вторичные (преобразователи тока и напряжения).
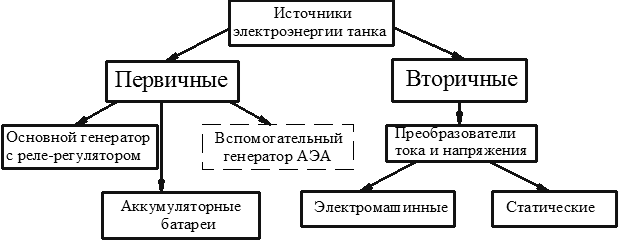
Рис. 2.1. Классификация источников электрической энергии танка
Аккумуляторные батареи
Общие сведения о стартерных аккумуляторных
Батареях
Особое место среди химических источников электроэнергии используемых в военной технике, занимают кислотные и щелочные аккумуляторы.
Аккумуляторные батареи, устанавливаемые в объектах БТВТ, являются источниками электрической энергии, обеспечивающими питание потребителей при неработающем двигателе или при недостаточной мощности, развиваемой генератором боевой машины.
Тип и конструкция танковых аккумуляторных батарей определяются условиями их разряда в стартерном режиме при пуске двигателя. Поскольку в этом режиме потребляется максимальная мощность, танковые аккумуляторные батареи называются стартерными.
Стартерный аккумулятор представляет собой химический источник тока, т.е. устройство, в котором происходит непосредственное преобразование энергии химической реакции двух реагентов (окислителя и восстановителя) в электрическую энергию.
Электрохимические процессы, происходящие в аккумуляторе, являются обратимыми. Это свойство позволяет аккумулятору многократно без замены электродов или электролита накапливать электрическую энергию и при необходимости отдавать ее во внешнюю цепь.
Процесс накапливания энергии аккумулятором называется зарядом, а процесс ее отдачи – разрядом.
В соответствии с предъявляемыми требованиями стартерные аккумуляторные батареи, допускающие многоразовое использование, должны иметь:
|
|
|
Максимальное рабочее напряжение, которое определяется величиной ЭДС и количеством последовательно соединенных в батарее аккумуляторов;
минимальные габариты и общая масса;
минимальное внутреннее сопротивление (особенно при пониженных температурах);
малое падение напряжения в процессе разряда;
высокие удельно-мощностные показатели (в частности, количество энергии, отдаваемой с единицы массы);
большую механическую прочность;
надежность и простоту обслуживания в эксплуатации;
низкую стоимость при массовом производстве.
Наиболее полно перечисленным требованиям удовлетворяют свинцово-кислотные аккумуляторы, которые имеют по сравнению со щелочными более высокие ЭДС (на 20…25%) и КПД, а также малое внутреннее сопротивление и однозначную зависимость плотности электролита от степени заряженности при заданной температуре. Кроме того, они менее сложны в эксплуатации и массовом производстве.
На современных танках применяются исключительно свинцово-кислотные аккумуляторы. Вследствие малого внутреннего сопротивления аккумуляторы такого типа обладают способностью отдавать большой ток и, следовательно, развивать высокую мощность при незначительном снижении напряжения.
Эти свойства свинцово-кислотных аккумуляторных батарей обеспечивают условия нормальной работы наиболее мощного потребителя в танке – стартера, нагрузочный ток которого при пуске дизельного двигателя достигает 1800…2000 А.
Принцип действия свинцово-кислотного аккумулятора
Прототип первой электрохимической батареи с напряжением 0,8В–“вольтов столб”– создал известный итальянский ученый Вольт в 1800 году.
В 1859 году французский инженер Планте изобрел первый кислотный аккумулятор, состоящий из двух свинцовых пластин (электродов), погруженных в электролит – водный раствор серной кислоты (рис. 2.2).
|
|
|
Принцип действия простейшего свинцово-кислотного аккумулятора основан на взаимодействии серной кислоты и окислов свинца, в результате чего на обоих электродах образуется сернокислый свинец  (сульфат свинца). Так как состав разноименных электродов одинаков, то поляризации не происходит и разность потенциалов между ними равна нулю.
(сульфат свинца). Так как состав разноименных электродов одинаков, то поляризации не происходит и разность потенциалов между ними равна нулю.

Рис. 2.2. Принцип устройства и работы свинцово-кислотного аккумулятора
Если же электроды подсоединить к источнику постоянного тока, на положительной пластине (окислителе) образуется перекись или двуокись свинца 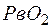 , а на отрицательной пластине (восстановителе) – губчатый свинец
, а на отрицательной пластине (восстановителе) – губчатый свинец  . При этом плотность электролита возрастает, т.к. в процессе заряда из электролита поглощается вода
. При этом плотность электролита возрастает, т.к. в процессе заряда из электролита поглощается вода  и выделяется серная кислота
и выделяется серная кислота  . Постепенно состав аккумуляторных платин становится разнородным и между ними возникает разность потенциалов, обусловленная поляризацией электродов.
. Постепенно состав аккумуляторных платин становится разнородным и между ними возникает разность потенциалов, обусловленная поляризацией электродов.
В другом случае, если к клеммам заряженного аккумулятора вместо источника тока подключить какой-нибудь потребитель электрической энергии, то аккумулятор будет разряжаться. При разряде аккумулятора на обеих пластинах снова образуется сернокислый свинец  , а в электролите часть серной кислоты замещается водой, вследствие чего плотность электролита уменьшается.
, а в электролите часть серной кислоты замещается водой, вследствие чего плотность электролита уменьшается.
Физические процессы, происходящие в свинцово-кислотном аккумуляторе, связаны со свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор серной кислоты.
При погружении отрицательного электрода в электролит от свинца начнут отщепляться положительно заряженные ионы, электрод начинает заряжаться отрицательно.
По мере протекания процесса разность потенциалов раствора серной кислоты и электрода возрастает. Следовательно, увеличивается и осмотическое давление положительных ионов раствора. Вследствие этого переход ионов свинца в раствор не может продолжаться долго и при какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца и силами электростатического поля и осмотического давления. При таком равновесии растворение свинца прекратится.
|
|
|
После погружения положительного электрода в раствор серной кислоты происходит то же явление, но результат получается иной. Двуокись свинца 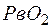 положительного электрода в ограниченном количестве переходи в раствор, где при соединении с водой
положительного электрода в ограниченном количестве переходи в раствор, где при соединении с водой  ионизируется на четырехвалентные ионы свинца
ионизируется на четырехвалентные ионы свинца  и одновалентные ионы окиси водорода
и одновалентные ионы окиси водорода  . Четырехвалентные ионы свинца
. Четырехвалентные ионы свинца  , осаждаясь на электроде, создают положительный потенциал относительно раствора.
, осаждаясь на электроде, создают положительный потенциал относительно раствора.
Химические процессы в свинцово-кислотном аккумуляторе описываются теорией “двойной сульфатации”, разработанной еще в 1883 году Дж. Гладстоном и А. Трайбом.
Согласно этой теории окислительно-восстановительные реакции, протекающие в аккумуляторе при разряде и заряде, выражаются уравнением:

Таким образом, при разряде аккумулятора расходуется серная кислота и образуется вода, а на обоих электродах – сульфат свинца. При заряде аккумулятора электрохимические процессы протекают в обратном направлении.
|
|
|


