 |
Коагуляция лиофобных золей
|
|
|
|
Лиофобные коллоидные системы термодинамически неравновесны, что связано с большим избытком свободной поверхностной энергии, вследствие этого они стремятся к агрегированию. Процесс укрупнения частиц за счет их слипания называется коагуляцией.
Одним из термодинамических факторов устойчивости дисперсных систем является электростатический фактор. Он определяется наличием двойного электрического слоя на поверхности частиц, что приводит к снижению поверхностного натяжения на границе раздела фаз между дисперсной фазой и дисперсионной средой.
В результате образования двойного электрического слоя у коллоидных частиц появляется заряд, вследствие чего одноименно заряженные частицы отталкиваются, и, в результате, система приобретает агрегативную устойчивость, т.е. устойчивость по отношению к слипанию.
Коагуляцию дисперсных систем могут вызвать различные факторы. Лиофобные коллоидные системы наиболее чувствительны к введению в систему электролитов, которые уменьшают электрокинетический потенциал частиц, тем самым снижая высоту потенциального барьера, который частицы должны преодолеть при сближении для того, чтобы произошла коагуляция.
Минимальная концентрация электролита, при которой наступает коагуляция, носит название порога медленной коагуляции. Порогом быстрой коагуляции называется такая концентрация электролита, при которой происходит исчезновение потенциального барьера, что приводит к слипанию каждой пapы сближающихся частиц.
По физической теории устойчивости лиофобных золей Дерягина-Ландау-Фервея-Овербека (ДЛФО) между мицеллами в коллоидной системе рассматриваются силы притяжения и отталкивания. Силы отталкивания действуют, когда перекрываются диффузные слои мицелл. Эти силы являются не просто кулоновским взаимодействием. Дерягин показал, что в этом случае проявляется расклинивающее давление. Притяжение мицелл друг к другу обусловлено Ван-дер-Ваальсовыми силами.
|
|
|
Коагуляция – это укрупнение частиц дисперсной фазы в результате их слипания. Наиболее важной является коагуляция под действием электролитов. Закономерности такой коагуляции:
1. Коагуляцию может вызвать любой электролит
2. Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции
3. Коагулирующим действием обладает тот ион электролита, который по знаку противоположен заряду коллоидной частицы
4. Эмпирическое правило Шульце - Гарди: чем больше заряд иона, тем больше его коагулирующая способность. Приближенно отношение порогов коагуляции одно-, двух- и трехзарядных ионов равно 1: 0,016: 0,0015. Величины, обратные порогу коагуляции, называют коагулирующей способностью и относятся как 1:60: 700 (теория ДЛФО дает соотношение 1:64:729).
5. В ряду органических ионов коагулирующая способность возрастает с повышением их адсорбционной способности
6. В ряду неорганических ионов с одинаковым зарядом их коагулирующая способность возрастает с уменьшением степени их гидратации (например, в ряду однозарядных катионов – от лития к рубидию)
7. В момент начала коагуляции электрокинетический потенциал снижается до критической величины в 0,03 В.
8. Ионы, вызвавшие коагуляцию, всегда присутствуют в полученных осадках.
Иногда при добавлении избыточного количества коагулирующего электролита происходит перезарядка мицелл. При этом коагулирующий ион становится потенциалопределяющим, формируется новый двойной электрический слой и золь восстанавливается – происходит его пептизация.
Лабораторная работа № 6.1
|
|
|
ЭЛЕКТРОФОРЕЗ
Цель работы: определение заряда частиц золя и расчет электрокинетического потенциала по значению скорости электрофореза.
При наложении электрического поля на систему, дисперсная фаза которой образована заряженными частицами (гидрозоли, суспензии, латексы, эмульсии и др.), распределение ионов в диффузном слое нарушается, при этом частицы вместе с плотным слоем ДЭС начинают двигаться в сторону одного из электродов, а диффузный слой перемещается в противоположном направлении.
 Рисунок 6.5 – Прибор для изучения электрофореза
Рисунок 6.5 – Прибор для изучения электрофореза
|
Прибор для изучения явления электрофореза представлен на рисунке 6.5, Он состоит из U-образной трубки 1, соединенной в верхней части мостиком с краном 4. Колена U-образной трубки снабжены кранами 2 и 3, диаметр отверстия которых равен диаметру трубки. Выше кранов 2 и 3 нанесена шкала с миллиметровыми делениями. Перед опытом прибор тщательно промывают хромовой смесью и дистиллированной водой. Затем вынимают краны 2 и 3, протирают и смазывают нейтральной смазкой, например, вазелином. (Внимание! Во время мытья прибора, помните о кранах 2, 3, 4! Их следует придерживать пальцами рук от выпадения).
Приготовленный заранее золь заливают в прибор так, чтобы были заполнены нижняя часть прибора и оба крана. После этого краны закрывают, избыток золя выливают и оба колена прибора промывают несколько раз дистиллированной водой, затем прибор заполняют почти доверху боковой жидкостью и укрепляют его на штативе.
Весьма важным является вопрос о составе боковой жидкости, посредством которой осуществляется контакт золя с электродами. Для получения более резкой границы между золем и боковой жидкостью во время опыта необходимо, чтобы электропроводность боковой жидкости была равной или немного больше электропроводности золя. Равенство электропроводностей важно еще и потому, что при расчете градиента потенциала, входящего в уравнение для вычисления величины z-потенциала, не вносится ошибка за счет неравномерности падения потенциала на расстоянии между электродами.
|
|
|
После заполнения прибора боковой жидкостью (в нашем случае в качестве боковой жидкости используется дистиллированная вода) в оба колена U-образной трубки погружают стеклянные мостики 5, заполненные студнем агар-агара, содержащим раствор KCl, благодаря чему студень хорошо проводит электрический ток. Другим концом мостики 5 погружают в 10%-й раствор CuSO4, в который также опущены медные электроды 6. Благодаря применению обратимых электродов, погруженных не в золь, а боковую жидкостьt устраняется поляризация электродов, перезарядка и коагуляция коллоидных частиц у электродов.
Непосредственно перед проведением опыта открывают на короткое время кран 4, чтобы уравнять уровни жидкости в обоих коленах прибора. Затем соединяют прибор с источником постоянного тока 7 и осторожно открывают краны 2 и 3. Обратите внимание на полярность электродов – это необходимо для определения знака заряда час тиц.
Как только уровень окрашенного столба золя достигнет нулевого деления градуировки шкалы (или любого другого, условно принятого за нулевое), включают секундомер и замечают, за какое время окрашенная граница передвинется на 5 мм. Скорость электрофореза замеряют три раза, каждый раз следя за перемещением окрашенной границы на 5 мм.
По окончании измерений прибор выключают и с помощью шнура или гибкой проволоки измеряют расстояние l между концами агар-агаровых мостиков. Расстояние l измеряется три раза и берется среднее значение полученных результатов.
Упрощенная методика определения z-потенциала позволяет использовать в качестве боковой жидкости дистиллированную воду.
Значение z-потенциала рассчитывается по уравнению Гельмголъца-Смолуховского для электрофореза, записанному в следующей форме:
 , (6.8)
, (6.8)
где h – вязкость среды, Па×с (для воды при 20°С h=1,002 мПа × с, вязкость воды при других температурах приводится в табл. 6 приложения);
|
|
|
H – напряженность электрического поля, В / м;
e а – абсолютная диэлектрическая проницаемость среды (e а =e 0 ×e);
e – относительная диэлектрическая проницаемость среды
(для воды e= 81), e0= 8,854×10-12 А × с / В – абсолютная диэлектрическая проницаемость вакуума;
w – скорость электрофореза, м / с;
u – электрофоретическая подвижность, м 2 с -1× В -1;
f – коэффициент, учитывающий форму частиц (f = 1 для цилиндрических частиц, ориентированных вдоль силовых линий электрического поля, f = 1/2 для цилиндрических частиц, ориентированных перпендикулярно силовым линиям, f = 2/3 – для сферических частиц).
Для расчета величины электрофоретической подвижности u нужно знать напряженность электрического поля H и скорость электрофореза w (среднюю величину для трех измерений):
 ,
, 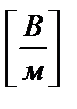 и
и  ,
,  .
.
Электрофоретическая подвижность равна:
 ,
, 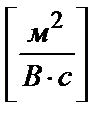 .
.
Подставляя значение электрофоретической подвижностивуравнение Гельмгольца-Смолуховского, находят значение величины z-потенциала. Экспериментальные и вычисленные величины заносят в таблицу 6.1.
Таблица 6.1 – Экспериментальные и вычисленные величины, полученные при изучении электрофореза гидрозоля (латекса) (указать какого)
Расстояние между электродами, l = …, м
| Напряжение на электродах Е, В | Напряженность электрического поля H, В / м | Перемещение раницы раздела s, м | Время перемещения t, с | Скорость электрофореза
 , м / с , м / с
| Электрофоретическая подвижность u, м2/с×В | z-потенциал, мВ |
| 0,005 | ||||||
| 0,010 | ||||||
| 0,015 |
Знак заряда коллоидной частицы исследуемого золя определяют по знаку электрода, к которому перемещалась окрашенная граница раздела золь/боковая жидкость (если граница раздела перемещалась в сторону положительного электрода, частицы золя имели отрицательный заряд, в противном случае – положительный).
После выполнения работы составляют отчет. В отчете указывают цель работы и дают ее краткое описание. Указывают объект исследования и приводят описание метода получения золя или латекса. Определив знак заряда частицы, записывают формулу мицеллы золя (латекса). Рассчитывают величину электрофоретической подвижности золя и значение z-потенциала золя. Значения электрофоретической подвижности, рассчитанные на основании экспериментальных данных, лежат в большинстве случаев в интервале (0,5 - 5,0)× 10-6  , что соответствует значениям z-потенциала от 1,5 до 75 мВ.
, что соответствует значениям z-потенциала от 1,5 до 75 мВ.
Привыполнении данной работы в качестве УНИРС исследуют влияние концентрации введенного в гидрозоль или латекс электролита на величину z-потенциала. Строят зависимости электрофоретической подвижности и величины z-потенциала от количества введенного электролита.
|
|
|
Объект исследования и величины концентраций используемых электролитов определяет преподаватель.
Лабораторная работа 6.2
|
|
|


