 |
Определение порога коагуляции гидрозоля гидроксида железа
|
|
|
|
Цель работы: определение порогов коагуляции гидрозоля гидроксида железа ионами различной природы.
П риборы и реактивы:
1. Фотоэлектроколориметр ФЭК-56.
2. Коническая колба на 500 мл.
3. Тридцать три пробирки емкостью 20 мл.
4 Градуированные пипетки на 5 мл.
5 Пипетка на 10 мл.
6. 2%-ный раствор хлорида железа или гидрозоль гидроксида железа приготовленный на его основе.
7. 0,00125 М раствор сульфата натрия.
8. 2 М раствор ацетата натрия
9. 4,6 М раствор хлорида натрия
Методика приготовления гидрозоля гндрокснда железа
Гидрозоль гидроксида железа готовят методом химической конденсации, происходящей в результате гидролиза хлорида железа согласно реакции:
FeCl3 + З Н2O 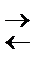 Fe(OH)3 + 3 HCl.
Fe(OH)3 + 3 HCl.
Равновесие реакции сдвигается вправо при повышении температуры и разведении реакционной смеси.
Для получения золя в колбу с 250 мл кипящей дистиллированной воды доливают 10 мл 2% раствора хлорида железа и кипятят несколько минут. При этом получается гидрозоль красно-коричневого цвета. Приготовленный гидрозоль охлаждают до комнатной температуры.
Ход работы:
За процессом коагуляции следят по изменению оптической плотности D, которую измеряют на приборе ФЭК-56.
Для изучения коагуляции золя гидроксида железа предварительно проводят следующие операции: берут 11 пробирок, нумеруют их и наливают воду в количестве, указанном в таблице 6.2. Затем в каждую пробирку добавляют по 10 мл золя.
Таблица 6.2 – Результаты изучения процесса коагуляции гидрозоля железа
Электролит................................ (название, концентрация)
| № пробирки | Объем воды, мл | Объем золя, мл | Объем электролита, мл | Концентрация электролита, моль / л | Оптическая плотность, D |
| 5,0 | 0,0 | ||||
| 4,5 | 0,5 | ||||
| 4,0 | 1,0 | ||||
| 3,5 | 1,5 | ||||
| 3,0 | 2,0 | ||||
| 2,5 | 2,5 | ||||
| 2,0 | 3,0 | ||||
| 1,5 | 3,5 | ||||
| 1,0 | 4,0 | ||||
| 0,5 | 4,5 | ||||
| 0,0 | 5,0 |
|
|
|
Далее в каждую пробирку вносят растворы хлорида или ацетата натрия в таком количестве, чтобы общий объем смеси в каждой пробирке составлял 15 мл (см. таблицу 6.2). По часам отмечают время внесения электролита в золь. Измерения на ФЭК-56 проводят с раствором хлорида натрия не ранее, чем через 30 минут, а с раствором ацетата натрия – через 15 минут.
Сульфат натрия вносят в золь гидроксида железа за 2 минуты до проведения измерений. Результаты проведенных измерений заносят в таблицу 6.2.
Такую таблицу составляют для каждого электролита отдельно, т.е., в результате работы всего должны быть составлены и заполнены 3 таблицы.
С целью экономии времени первыми следует приготовить пробирки с раствором хлорида натрия, затем – с раствором ацетата натрия. При проведении опыта необходимо следить за временем.
Прежде, чем залить в кювету исследуемый раствор для измерения оптической плотности, кювету следует предварительно ополоснуть этим раствором.
Вычисление концентрации раствора электролита в системе, содержащей электролит, проводят по соотношению объема и молярности исходной и конечной системы по формуле:
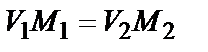 .
.
Например, для 5-ой пробирки с ацетатом натрия; 3×2 = С к×15, т.е. C к = 0,4 моль / л.
На основании результатов строят зависимость D = f (C), которая должна иметь примерно такой вид, как показано на рисунке 6.6. По этой зависимости устанавливают порог коагуляции С к. На основании полученных результатов записывают формулу мицеллы золя гидроксида железа и объясняют влияние природы иона на коагуляцию.

Рисунок 6.6 – Зависимость оптической плотности золя от концентрации электролита
|
|
|
Лабораторная работа 6.3
|
|
|


