 |
Второй и третий законы термодинамики
|
|
|
|
Назовем термодинамическую систему изолированной, если она не обменивается с внешней средой ни энергией, ни веществом. Из определения энтропии по Больцману (25.2) видно, что энтропия изолированной системы при равновесных обратимых процессах остается постоянной и равна максимальному значению:

Это видно и из определения энтропии по Клаузиусу (25.7). При 
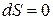 , т. е. S = const.
, т. е. S = const.
При необратимом процессе, когда изолированная система переходит из неравновесного состояния в равновесное, энтропия системы возрастает. Действительно, так как

то из неравенства
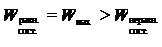
видно, что
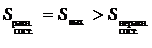
Возрастание энтропии при необратимом процессе видно и из выражения (25.8). При 

Из вышесказанного следует, что энтропии изолированной системы может только возрастать:
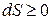 (26.1)
(26.1)
Это утверждение называют законом возрастания энтропии или вторым законом термодинамики.
При температуре 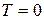 любая система находится в основном состоянии, термодинамическая вероятность которого
любая система находится в основном состоянии, термодинамическая вероятность которого 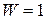 . При этом
. При этом

Отсюда можно сказать, что энтропия всякой системы стремится к нулю при стремлении к нулю температуры:
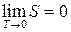 (26.2)
(26.2)
Это утверждение называют теоремой Нериста или третьим законом термодинамики.
ГЛАВА 8. РЕАЛЬНЫЕ ГАЗЫ
Силы межмолекулярного взаимодействия в газах
Поведение молекул реальных газов отлично от поведения молекул газа. В реальных газах молекулы взаимодействуют друг с другом. Между молекулами одновременно существуют силы взаимного притяжения и силы взаимного отталкивания.
Различают три типа сил взаимного притяжения молекул: ориентационные, индукционные и дисперсионные. Все они имеют электрическую природу. Ориентационные силы притяжения действуют между полярными молекулами, индукционные — между полярной и неполярной молекулами, а дисперсионные — между неполярными молекулами, а также между любыми другими парами молекул.
|
|
|
Силы взаимного отталкивания молекул проявляются на очень малых расстояниях, когда перекрываются электронные оболочки молекул. Существование этих сил объясняется в квантовой механике на основании принципа Паули.
Силы межмолекулярного взаимодействия в сильной степени зависят от расстояния между молекулами. Рассмотрим две молекулы газа. Одну из них будем условно считать неподвижной. Поместим ее в точку  , являющейся началом декартовых координат. Положение другой движущейся молекулы будем задавать с помощью радиус-вектора
, являющейся началом декартовых координат. Положение другой движущейся молекулы будем задавать с помощью радиус-вектора  , проведенного из точки
, проведенного из точки  . На движущуюся молекулу со стороны неподвижной молекулы будут действовать одновременно две силы: сила отталкивания
. На движущуюся молекулу со стороны неподвижной молекулы будут действовать одновременно две силы: сила отталкивания 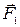 и сила притяжения
и сила притяжения 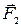 , причем
, причем
 ,
, 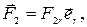 (27.1)
(27.1)
где 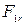 и
и 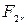 — проекции сил
— проекции сил 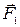 и
и 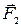 на направление радиус-вектора
на направление радиус-вектора 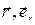 — единичный вектор радиус-вектора
— единичный вектор радиус-вектора  .
.
Проекции сил 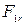 и
и 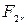 зависят от расстояния
зависят от расстояния 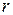 между взаимодействующими молекулами. Расчет дает
между взаимодействующими молекулами. Расчет дает
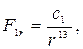
(27.2)
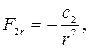 (27.3)
(27.3)
где 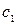 и
и 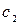 — постоянные положительные коэффициенты, зависящие от химического состава молекул газа.
— постоянные положительные коэффициенты, зависящие от химического состава молекул газа.
Результирующая сила межмолекулярного взаимодействия


где

(27.4)
— проекция силы 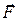 на направление радиус-вектора
на направление радиус-вектора  .
.
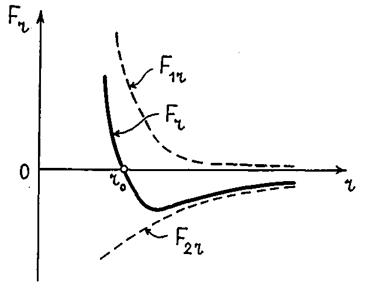
Изобразим графически зависимости (27.2)–(27.4) (рис 27.1).
|
Рис. 27.1
Из рис. 27.1 видно, что при  силы
силы 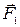 и
и 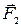 взаимно уравновешиваются и результирующая сила
взаимно уравновешиваются и результирующая сила 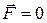 . Если
. Если 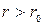 , то преобладают силы взаимного притяжения, если
, то преобладают силы взаимного притяжения, если  — преобладают силы отталкивания. Таким образом,
— преобладают силы отталкивания. Таким образом, 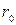 — это то равновесие расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
— это то равновесие расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
|
|
|


