 |
Инициирование полимеризации
|
|
|
|
Радикальная полимеризация
Радикальная полимеризация применима только к мономерам, содержащим двойные связи С=С. При этом простейший мономер – этилен малоактивен, для его полимеризации необходимы высокие температура и давление, и получаемый в этих условиях полимер называют полиэтиленом высокого давления. Низкая активность этилена связана с симметрией его молекулы, вследствие чего двойная связь устойчива.
Введение в молекулу мономера любого заместителя приводит к поляризации двойной связи и повышению активности мономера. При электроположительных заместителях (чаще всего углеводородный радикал R) происходит смещение электронов p-связи в сторону головы молекулы, а при электроотрицательных (например, атом галогена – Х) – в сторону хвоста:
–δ +δ +δ –δ
СН2 = СН СН2 = СН
| |
R Х
При наличии двух и более заместителей играют роль их полярность, расположение и размеры. Например, несимметричный 1,1-дихлорэтилен СCl2=СН2 (винилиденхлорид) полимеризуется быстрее винилхлорида вследствие большей поляризации двойной связи, тогда как симметричный 1,2-дихлорэтилен ClСН=СНCl вообще не способен полимеризоваться. Также не полимеризуются трихлор- и тетрахлорэтилены, но здесь уже причиной их неактивности являются пространственные затруднения (тетрафторэтилен способен полимеризоваться, так как размеры атома фтора существенно меньше, чем хлора).
Мономеры c сопряжёнными двойными связями полимеризуются довольно хорошо, при этом наличие заместителя у второго углеродного атома обычно делает мономер более активным, поэтому в ряду бутадиен ® изопрен ® хлоропрен скорость полимеризации заметно возрастает.
|
|
|
Инициирование полимеризации
Для образования свободных радикалов необходим гомолитический распад связи в молекуле любого вещества, присутствующего в системе. Такой распад происходит под действием различных внешних энергетических воздействий.
Если при этом не вводят специальные вещества (инициаторы), то инициирование часто называют физическим, хотя в его основе, конечно, лежат химические реакции. Среди этих видов инициирования, называемых по природе внешнего источника энергии, основными являются термическое, фотохимическое и радиационное.
Термическое инициирование. При повышении температуры повышается кинетическая энергия молекул, и при их столкновении становится возможным распад связей:
СН2=СН + СН2=СН ¾® ·СН–СН2–СН2–·СН
| | | |
R R R R
Такой бифункциональный активный центр существует недолго и после присоединения одной или двух молекул мономера распадается на два монорадикала:
·СН–СН2–СН2–СН–СН2–·СН ¾® ·СН–СН3 + СН2=С–СН2 –·СН
| | | | | |
R R R R R R
Возможны и другие схемы образования свободных радикалов, в том числе с участием молекул растворителя, но всегда образующиеся активные центры монофункциональны.
Возможность термических реакций инициирования радикальной полимеризации нужно учитывать при переработке и очистке мономеров.
Фотохимическое инициирование. Для инициирования светом чаще всего используют ультрафиолетовое излучение, как несущее наибольшую энергию. При поглощении молекулой мономера кванта световой энергии (hn) молекула переходит в возбуждённое состояние, но химическая реакция ещё не происходит:
СН2= СН + hn ¾® СН2 = СН*
| |
R R
Эта возбуждённая молекула может растерять свою избыточную энергию (дезактивация) или превратиться в два свободных радикала в результате спонтанного распада, или прореагировать с другой молекулой мономера:
|
|
|
СН2= СН* ¾® ·СН= СН + Н· (спонтанный распад)
| |
R R
СН2= СН* + СН2=СН
| | —› ·СН–СН2–СН2–·СН
R R | |
R R
Образовавшийся в последней реакции бирадикал точно так же, как при термическом инициировании, превращается вскоре в два монорадикала.
Для фотохимического инициирования характерны очень низкие энергии активации, что позволяет проводить полимеризацию при низких температурах. Однако большая часть световой энергии теряется при дезактивации, и эффективность инициирования (число свободных радикалов, образовавшихся на один квант поглощённой энергии) редко превышает 0,1.
Эффективность фотохимического инициирования существенно возрастает в присутствии галогенсодержащих растворителей (например, ССl4) вследствие снижения вероятности дезактивации возбуждённых молекул:
СН2=СН* + ССl4 ¾® СlСН2–·СН + ·ССl3
| |
R R
Радиационное инициирование. Полимеризацию можно инициировать различными ионизирующими излучениями высокой энергии (g-лучи, рентгеновское и т.п.). При действии такого излучения (>>®) на мономер (М) возможны два первичных процесса: ионизация с отщеплением электрона и сильное возбуждение молекулы:
 М + >>® ¾¾® М+ + е–
М + >>® ¾¾® М+ + е–
М**
Образовавшийся электрон может присоединиться к другой молекуле мономера, превратив её в анион:
М + е– ¾® М–
Сильно возбуждённая молекула мономера при столкновениях с другими молекулами может постепенно растерять свою избыточную энергию (дезактивация) или в результате описанных выше реакций образовать два свободных радикала.
Как видно из приведённых схем, при радиационном инициировании могут образоваться активные центры различной природы: свободные радикалы, катионы и анионы. Поэтому, в принципе, может протекать любой вид полимеризации, и это зависит от типа мономера, природы растворителя, температуры и пр. Однако в большинстве случаев полимеризация протекает по радикальному механизму, и по своим закономерностям она очень близка к фотохимической.
Электрохимическое инициирование. В мягких условиях можно получать полимеры за счет образования свободных радикалов и ионов при электрохимическом воздействии на мономеры или специальные добавки, вводимые в анодную или катодную зону. Например, при «анодном окислении» в качестве источника свободных радикалов выступают анионы кислот:
|
|
|
RCOO ־ → RCOO· →·R· + CO
-e-
Образующиеся при этом свободные радикалы способны инициировать полимеризацию бутадиена, стирола, изопрена, метилметакрилата, винилхлорида, винилацетата. В присутствии ионов SO42- полимеризацию мономеров инициируют ион-радикалы:
+M
SO42- → [SO4] -· → -SO4M·
-e-
В случае катодного восстановления электрохимическими инициаторами служат ионы водорода, протонированные мономеры, кислород.
Кроме рассмотренных вариантов, образование свободных радикалов возможно при действии на мономер интенсивных механических нагрузок, магнитных полей и других факторов, способных вызвать гомолитический распад связи.
Достоинством инициирования только физическими воздействиями является чистота получаемых полимеров, так как, кроме мономера, никаких других продуктов в системе нет, и практически весь мономер превращается в полимер. Поэтому такие методы полимеризации изредка используют для получения сверхчистых полимеров.
Для получения крупнотоннажных полимеров используют исключительно химическое инициирование, при этом в систему вводят специальные вещества (инициаторы), распадающиеся на свободные радикалы легче, чем мономер. Обычно гомолитический распад связей в молекулах инициатора происходит при нагревании. Поэтому для каждого инициатора характерна так называемая температура распада, т.е. температура, при которой скорость образования свободных радикалов оказывается достаточной для успешного проведения полимеризации.
Наиболее распространённую группу инициаторов составляют пероксиды – соединения, имеющие ковалентную связь О–О. Распад всех пероксидов происходит однотипно, именно по этой связи, при этом свободные радикалы имеют неспаренный электрон на атоме кислорода:
Х–О–О–Х' ¾® Х–О· + ·О–Х'.
Простейшим представителем инициаторов такого типа является пероксид водорода (НО–ОН), который достаточно активно инициирует полимеризацию, но слишком нестабилен при хранении, быстро разлагается, и поэтому для практических целей его применяют редко.
|
|
|
Из неорганических пероксидов чаще всего используют соли надсерной кислоты (персульфаты), из которых наиболее доступен персульфат калия (К2S2О8). Такие инициаторы в органических веществах нерастворимы, поэтому их применение возможно только при эмульсионной полимеризации, весьма распространённой в промышленности синтетического каучука.
При растворении персульфата в водной фазе прежде всего происходит его диссоциация (как любой неорганической соли), и образуется анион, содержащий пероксидную группу:
O O O O
|| || || ||
К–О–S–O–O–S–O–K ¾® 2 K+ + –О–S–O–O–S–O–.
|| || || ||
O O O O
Этот анион при нагревании распадается как любой другой пероксид, т.е. по связи кислород–кислород, с образованием весьма активных свободных радикалов:
O O О
|| || ||
–О–S–O–O–S–O– ¾® 2 –О–S–O·
|| || ||
O O О
Персульфат калия успешно применяют в производстве синтетических каучуков при температурах 48¸50оС (горячая эмульсионная полимеризация).
Из органических гидропероксидов общего вида RО–ОН наиболее доступным продуктом является гидропероксид изопропилбензола (ГПИПБ), распадающийся по обычной схеме:
СН3 СН3
| |
С6Н5–С–О–ОН ¾® С6Н5–С–О· + ·ОН
| |
СН3 СН3
Однако слишком высокая температура распада (130¸140оС) не позволяет использовать ГПИПБ как индивидуальный инициатор для промышленных процессов полимеризации.
Пероксиды общего вида RО–ОR (например, пероксид ди-изопропилбензола) при нагревании тоже распадаются на свободные радикалы, но для этого нужны ещё более высокие температуры, поэтому их используют не как инициаторы полимеризации, а для вулканизации каучуков. Для инициирования полимеризации применимы диацилпероксиды, в которых R – остаток какой-либо карбоновой кислоты. Самым распространённым представителем инициаторов такого типа является пероксид бензоила:
О О О
|| || ||
С6Н5–С–О–О–С–С6Н5 ¾® 2 С6Н5–С–О·
Пероксид бензоила достаточно активно распадается при температурах 70¸80оС, и его часто применяют при полимеризации в массе мономера или в растворе (в производстве пластмасс).
Другую большую группу инициаторов радикальной полимеризации составляют азо- и диазосоединения, содержащие группу –N=N–. Активные азосоединения можно изобразить общей формулой, где R и R' – обычно простые углеводородные радикалы, например СН3; Х – электроотрицательный заместитель:
R R
׀ ׀
Х – С–N=N– С – Х
׀ ׀
R' R'
Из этой группы инициаторов чаще всего применяют динитрил азо- бис -изомасляной кислоты – соединение, в котором R и R' – метильные группы, а Х – нитрильная группа СºN. Распад инициатора происходит по схеме, общей для всех азосоединений:
|
|
|
CH3 CH3 CH3
| | |
NºC–C–N=N–C–CºN ¾® 2 NºC–C· + N2
| | |
CH3 CH3 CH3
Инициатор работает при температурах 60¸70оС, но тоже только в органических средах, поэтому его иногда используют при получении некоторых пластмасс. Интересно, что получаемые на таких инициаторах полимеры на концах макромолекул содержат функциональные группы Х.
Таким образом, из рассмотренных инициаторов только три обладают довольно низкими температурами распада и нашли промышленное применение, причём в производстве СК применяют только один – персульфат калия.
Экспериментально установлено, что с понижением температуры полимеризации улучшается качество синтетических каучуков, получаемых в эмульсии по радикальному механизму. Поэтому уже много лет назад были разработаны окислительно-восстановительные системы инициирования, позволяющие проводить полимеризацию при температурах около 5оС. В таких системах используют как минимум два реагента – окислитель и восстановитель, в результате реакции между которыми образуются свободные радикалы. Все системы подразделяют на три типа.
Системы 1-го типа, в которых при окислительно-восстановительной реакции образуется один свободный радикал. В качестве окислителя обычно используют гидропероксид, а в качестве восстановителя – ионы металлов переменной валентности в низшей степени окисления. При этом протекает реакция
RO–OH + Me+n ¾® RO· + Me+n+1 + HO-.
Хотя рост каждой макромолекулы длится несколько секунд, для достижения высоких степеней превращения мономера в полимер требуется несколько часов, и применяемая система инициирования должна обеспечить образование свободных радикалов в течение всего этого времени.
Из гидропероксидов часто используют самый доступный и уже упомянутый выше гидропероксид изопропилбензола (ГПИПБ), хотя существуют и могут быть использованы другие, более активные гидропероксиды, например изопропилциклогексилбензола.
Из большого числа металлов переменной валентности практически оказалось пригодным только железо (Fe+2), вводимое в водную фазу в виде сульфата FeSО4, поскольку другие ионы более активны и вызывают слишком быстрый распад гидропероксида. Однако даже при использовании Fe+2 его концентрация должна быть достаточно низкой, и для этого применяют широко распространённый в аналитической химии комплексообразователь Трилон Б (динатриевая соль этилендиаминтетра-уксусной кислоты). Ион Fe+2 в этом комплексе дополнительно связан координационными связями
| Na–O–C(O)–CH2–N–CH2–C(O)–O CH2 Fe CH2 Na–O–C(O)–CH2–N–CH2–C(O)–O | с атомами азота, что сильно ограничивает возможности его диссоциации, и кон- центрация Fe+2 |
оказывается невысокой и постоянной в течение длительного времени.
Кроме того, чтобы уменьшить количество железа, попадающего в каучук при выделении его из латекса, применяют дополнительный восстановитель – ронгалит – продукт взаимодействия формальдегида с сульфитом натрия, имеющий формулу HO–CH2–S(O)–O–Na. Под действием ронгалита Fe+3 превращается снова в Fe+2, и таким образом один ион железа может многократно участвовать в реакции образования свободных радикалов. По железу эта система является обратимой:
+ RO–OH

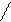
 RO· + HO–
RO· + HO–
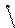 Fe+2 Fe+3
Fe+2 Fe+3
+ ронгалит
 |
Такая окислительно-восстановительная система сейчас является практически единственной, применяемой во всём мире для холодной (+5оС) эмульсионной полимеризации при синтезе каучуков.
Системы 2-го типа, в которых при окислительно-восстановительной реакции образуется два свободных радикала. В таких системах окислителем является также гидропероксид (например, ГПИПБ), а в качестве восстановителя применяют органические соединения, чаще всего содержащие подвижный атом водорода (АН):
RO–OH + АН ¾® RO· + H2О + А·.
Для роста цепей достаточно активных радикалов RO·, поэтому второй образующийся радикал (А·) может быть и неактивен, более того, чем пассивнее радикал А·, тем легче протекает эта реакция. Примером инициатора этого типа является разработанная в СССР система на основе ГПИПБ и гидрохинона:

семихиноидный
радикал
Семихиноидный радикал неактивен, но может окисляться дальше с образованием нового радикала RO· и хинона:
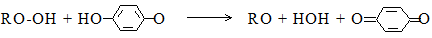
Семихиноидный радикал не способен взаимодействовать с молекулами мономера, но может присоединяться к растущим полимерным цепям, прекращая их рост; так же может действовать и хинон, поэтому в их присутствии полимеризация невозможна. Для снятия этого нежелательного эффекта в инициирующую систему вводят дополнительный восстановитель – сульфит натрия Na2SO3, который восстанавливает хинон до семихиноидного радикала, а его – до гидрохинона. Такой способ инициирования одно время применялся в отечественной промышленности СК, но после разработки систем 1-го типа был быстро заменён ими.
Системы 3-го типа. При окислительно-восстановительной реакции образуются не свободные радикалы, а очень нестойкие соединения, быстро распадающиеся на радикалы. Примером такой реакции является взаимодействие гидропероксидов со вторичными аминами:
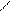
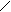 R' R'
R' R'

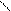 RO–OH + HN –® H2O + RO–N –® RO· + R'–N·–R''.
RO–OH + HN –® H2O + RO–N –® RO· + R'–N·–R''.
R'' R''
Системы такого типа отличаются от предыдущих возможностью использования их в неводных системах, однако пока они не представляют практического интереса.
Реакции роста цепи
Радикал, образовавшийся на стадии инициирования (например, RO·), только один раз участвует в реакции с мономером, и на этом его роль исчерпывается:
RO· + М ¾® RO – М·
Далее реакция роста цепи протекает только как присоединение мономера к такой растущей цепи:
~~М· + М ¾® ~~М–М·
Следовательно, на скорость реакции роста должны влиять активности мономера и образовавшегося из него радикала. Выше отмечалось, что этилен – мономер малоактивный, но образовавшийся из него радикал ~СН2–·СН2 очень активен, так как облако неспаренного электрона сконцентрировано (локализовано) на одном углеродном атоме. При наличии в молекуле мономера одного заместителя его активность повышается, но образующийся из него радикал ~СН2–·СН–Х оказывается менее активным из-за делокализации электронного облака на заместитель. Ещё более активные мономеры с двумя заместителями дают ещё менее активные радикалы ~СН2–·СХ2 вследствие ещё более сильной делокализации электронного облака.
Таким образом, чем активнее мономер, тем пассивнее образующийся из него радикал. Поэтому скорости реакций роста цепи для разных мономеров отличаются между собой весьма незначительно. Обычно рост цепи длится всего несколько секунд, и за это время к растущей цепи успевает присоединиться до 50 тыс. звеньев.
При полимеризации мономера с несимметричной молекулой (например, с одним заместителем) могут образоваться радикалы различного строения, в зависимости от того, каким концом молекула присоединяется к активному центру:
RO· + СН2=СН ¾® RO –СН–·СН2 или RO – СН2–·СН
| | |
Х Х Х
радикал типа А радикал типа Б
Радикал типа А должен обладать более высокой реакционной способностью, так как облако неспаренного электрона у него локализовано. Радикал типа Б, в котором имеет место делокализация электронного облака, более стабилен.
Из общих принципов термодинамики известно, что, если при реакции может образоваться несколько продуктов, процесс идёт преимущественно в направлении получения наиболее стабильных соединений. В этой связи из двух возможных направлений реакции роста следует считать наиболее вероятным образование радикалов типа Б. Следовательно, в полимерной цепи звенья соединены преимущественно по типу ''голова к хвосту'', однако никакого стереорегулирования при этом не происходит, и при радикальной полимеризации полимеры оказываются атактическими.
При полимеризации диенового мономера (например, 1,3-бутадиена) в реакции с активным центром первоначально принимает участие одна двойная связь (1-2 или 3-4, в случае бутадиена это безразлично), при этом присоединение также может происходить по двум вариантам:
1 2 3 4
RO· + СН2=СН–СН=СН2 ¾® RO–СН–·СН2 или RO–СН2–·СН
| |
СН СН
|| ||
СН2 СН2
радикал типа А радикал типа Б
Так же, как в предыдущем случае, радикал типа А намного менее стабилен вследствие локализации электронного облака на углеродном атоме без заместителей, и поэтому его образование маловероятно.
В радикале типа Б неспаренный электрон свободного радикала находится в сопряжении с p-электронами двойной связи, в результате чего образуется единое облако из трёх электронов. Поэтому более правильно такую структуру представить формулой:
RO–СН2–[СН – СН – СН2]·, где положение неспаренного электрона не определено. В этой связи структуру радикала Б можно рассматривать как вполне определённую, в которой обобщённое электронное облако сдвинуто в сторону 2-го углеродного атома. При сдвиге электронного облака в сторону 4-го атома углерода получим структуру Б':
RO – СН2 – СН=СН –·СН2
Естественно, что присоединение следующей молекулы мономера происходит к активному центру в какой-то определённой форме (Б или Б'). Очевидно, что при присоединении молекулы мономера к радикалу в форме Б он превращается в звено в положении 1,2-, а при присоединении к радикалу в форме Б' – в звено в положении 1,4- (цис- или транс-).
Получаемые полимеры содержат все типы звеньев (1,2-, 1,4- цис и 1,4- транс) и поэтому тоже являются нерегулярными. Обычно содержание звеньев типа 1,2- составляет 17¸20 %, а среди звеньев типа 1,4- преобладает транс- конфигурация (неоптимальное для каучуков строение).
При полимеризации диенов более сложного строения (например, изопрена или хлоропрена) набор возможных звеньев увеличивается, так как появляются звенья в положении 3,4-.
|
|
|


