 |
Анизотропия кристаллов
|
|
|
|
Структура анизотропного кристалла
Для того чтобы понять природу анизотропии горных пород, необходимо рассмотреть строение анизотропных кристаллов. Сделаем это на примере кристалла графита, как наиболее простого однокомпонентного минерала.
Графит - полиморфная модификация кристаллического углерода. Атомы углерода в графите располагаются слоями, каждый из которых представляет собой гексагональную сетку. Атомы в слое лежат приблизительно в одной плоскости. Каждый атом имеет в ближайшем окружении три атома на расстоянии 1, 42  . Совершенная спайность в графите проходит параллельно гексагональным слоям. Отдельные слойки в графите отстоят друг от друга на расстоянии 3, 40
. Совершенная спайность в графите проходит параллельно гексагональным слоям. Отдельные слойки в графите отстоят друг от друга на расстоянии 3, 40  (рис. 11. 28, а). Графит обладает ярко выраженными свойствами механической анизотропии, он легко разделяется на слойки по плоскостям спайности, но внутри слойка имеет высокую прочность.
(рис. 11. 28, а). Графит обладает ярко выраженными свойствами механической анизотропии, он легко разделяется на слойки по плоскостям спайности, но внутри слойка имеет высокую прочность.
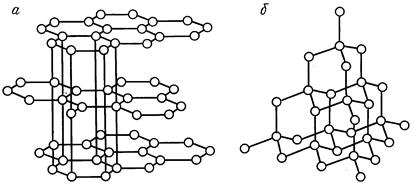
Рис. 11. 28. Структуры графита (а) и алмаза (б)
Другой модификацией углерода, имеющей ярко выраженные свойства изотропного тела, считается алмаз. Кристаллическая структура алмаза (рис. 1. 10, б) близка к кубической гранецентрированной решетке, в которой атомы углерода размещены в вершинах элементарной кубической ячейки и в центрах ее граней. От обычной кубической гранецентрированной решетки структура алмаза отличается наличием четырех атомов углерода, размещенных в центрах четырех из восьми маленьких кубов элементарного куба. Каждый атом углерода в решетке очень прочно связан с четырьмя соседними тетраэдрически размещенными около него атомами. Межатомное расстояние в алмазе составляет 1, 54  . Алмаз - изотропный минерал с очень высокой твердостью. Для сравнения приведем ниже значения некоторых свойств графита и алмаза.
. Алмаз - изотропный минерал с очень высокой твердостью. Для сравнения приведем ниже значения некоторых свойств графита и алмаза.
|
|
|
Графит Алмаз
Плотность, кг/м3 2220-2250 3510-3550
Прочность при растяжении, МПа 3, 5-17 1800
Твердость по шкале Мооса 1 10
 Модуль Юнга, МПа 0, 5 ·104 113 ·104
Модуль Юнга, МПа 0, 5 ·104 113 ·104
Для того чтобы понять столь значительную разницу в свойствах двух минералов, состоящих из атомов одного и того же элемента, необходимо ознакомиться с природой физических связей внутри кристалла и кристаллов между собой.

Природа связей элементов горных пород
Изучая строение горных пород, приходится сталкиваться с тремя типами связей отдельных ее элементов между собой в минералах, а именно: ионными, ковалентными и молекулярными.
Ионная связь образуется благодаря взаимному притяжению ионов противоположных знаков - положительных (катионов) и отрицательных (анионов). На определенном уровне ионы могут рассматриваться как непроницаемые сферы, образующие кристалл за счет электростатического кулоновского взаимодействия.
При существенном сближении ядер атомов происходит деформация электронных оболочек ионов, и возникают большие силы отталкивания. Благодаря этому ионные структуры стремятся к созданию решеток с плотнейшей упаковкой атомов. Энергия связи в ионных кристаллах достигает 105-106 Дж/моль.
Ковалентная связь между частицами обусловлена тем, что два электрона принадлежат одновременно двум атомам. Такая связь также называется валентной или гомеополярной. По мнению Н. Ашкрофта, электроны в ковалентных кристаллах не могут строго локализоваться в окрестностях иона, а распределяются чаще вдоль некоторых предпочтительных направлений - вдоль линий, соединяющих каждый центральный ион с его ближайшими соседями. Подобное поведение плотности заряда считается характерной особенностью ковалентных кристаллов. Энергия связи в ковалентных кристаллах такого же порядка, что и в ионах, и достигает 105-106 Дж/моль.
|
|
|
Молекулярная (ван-дер-ваальсова) связь определяется наличием у молекул природных или индуцированных электрических моментов. Энергия связи молекулярных решеток обычно имеет порядок 103-104 Дж/моль.
Твердость кристалла и другие его механические свойства зависят от характера связей. Зная структуру графита, нетрудно понять, что внутри слойка атомы, связанные силами ионного взаимодействия, разделить гораздо труднее, чем разделить между собой два слойка графита, которые удерживаются друг около друга слабыми ван-дер-ваальсовыми связями. Эта разница объясняет наличие спайности в некоторых минералах, которая проходит по плоскости наименьших связей.
Атомы углерода в структуре алмаза образуют прочные ковалентные связи, благодаря чему алмаз является самым твердым из известных в природе веществ.
Если кристалл подвергнуть механическому воздействию, то его структура может нарушиться или даже разрушиться, причем степень сопротивляемости внешним воздействиям зависит от энергии решетки данного кристалла. При прочих равных условиях (например, в изотипных кристаллах) твердость увеличивается с увеличением заряда ионов и уменьшением межионного расстояния. Кроме того, твердость зависит от типа структуры и ее коэффициента упаковки. Исследуя полиморфные модификации какого-либо вещества, можно заметить, что максимальной энергией решетки обладают те модификации, атомы которых характеризуются высокой координацией и, следовательно, более плотно упакованы, чему соответствуют увеличенный удельный вес и повышенная твердость кристалла.
Максимальной твердостью отличаются те грани или направления в кристаллах, которые наиболее заселены атомами.
Свойства полиморфных модификаций (по И. Костову)
Анатаз Брукит Рутил
Твердость по Моосу5, 7 6, 0 6, 3
Плотность, г/см3 3, 84 3, 90 4, 24
|
|
|
Анизотропия свойств заложена в основу многих минералов. По кристаллическим типам минералы подразделяются на гомодесмические и гетеродесмические. Первые характеризуются структурами, в которых присутствуют связи одного типа, и они одинаковы по всем направлениям. Обычно это кристаллы с ионной или ковалентной связью. Вторые характеризуются тем, что в разных частях и по разным направлениям связи в них неодинаковые. Некоторые группы атомов соединены друг с другом одним типом связей, а соединение групп осуществляется другим типом связей. Эти минералы подразделяются на островные, цепочечные, слоистые и каркасные.
Симметрия свойств минерала зависит от характера упаковки атомов по разным кристаллографическим осям. В направлениях одинаковой плотности упаковки атомов минералы имеют одинаковые свойства. По этому признаку минералы подразделяются на моноанизотропные и полианизотропные. Полианизотропные минералы имеют несколько осей симметрии свойств, моноанизотропные - одну ось симметрии. Моноанизотропией обладают в основном слоистые минералы, имеющие неопределенные соотношения продольных и поперечных размеров, остальные минералы из группы гетеродесмических, обладающие вытянутой формой и разной плотностью упаковки в нескольких направлениях, относятся к полианизотропным разновидностям.
|
|
|


