 |
Способы создания проблемных ситуаций
|
|
|
|
· Использование противоречий между изучаемыми фактами и имеющимися знаниями, на основе которых учащиеся высказывают неправильные суждения.
· Построение гипотезы на основе известной теории, а затем её проверка.
· Нахождение рационального пути решения, когда заданы условия и конечная цель
· Использование принципа историзма.
· Демонстрация или сообщение некоторых фактов, которые неизвестны учащимся и требуют для объяснения дополнительной информации, побуждают к поиску новых знаний
2. Проблемно-развивающий эксперимент при изучении свойств гидросульфита натрия
Гидросульфит натрия может проявлять в химических реакциях свойства восстановителя или окислителя. Такая возможность обусловлена промежуточной степенью окисления атомов серы в молекулах этого вещества. Поскольку степень окисления атомов серы в гидросульфите натрия равна +4, то в определенных условиях в химических реакциях она может повышаться до значения +6 или понижаться, например, до 0.
Проведенная научно-исследовательская работа позволила разработать эксперименты, характеризующие гидросульфит натрия не только как восстановитель, но и как окислитель. Это новые проблемные эксперименты, которые предлагаются именно для школьных условий с учетом возможностей школьного химического кабинета и его материальной базы.
Характеристику окислительно-восстановительных свойств гидросульфита натрия целесообразно начинать с проведения экспериментов, устанавливающих восстановительную функцию этого соединения в химических реакциях, так как она наиболее типична для соединения серы, в которых атомы серы находятся в данной степени окисления.
|
|
|
Раствор гидросульфита натрия готовит учитель, растворяя 10 г. пиросульфита натрия в 90 мл дистиллированной воды. При растворении образуется раствор кислой соли:
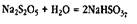
2.1 Восстановительные свойства гидросульфита натрия
Опыт 1. Взаимодействие гидросульфита натрия с гидроксидом меди(П)
Реактивы и оборудование: 10%-ный раствор сульфата меди(П), 10%-ный раствор гидроксида натрия, раствор гидросульфита натрия; пробирки, спиртовка, фарфоровая чашечка. Выполнение опыта. В пробирку с 3 мл раствора гидросульфита натрия добавляют такой же объем раствора сульфата меди(И) и затем постепенно при перемешивании содержимого пробирки по каплям добавляют 1 мл раствора щелочи. Выпадает желтый осадок При нагревании пробирки цвет осадка изменяется на темно-красный. Осадок вместе с раствором сливают в фарфоровую чашечку, отделяют осадок от раствора и рассматривают полученный осадок.
Обсуждение опыта и вывод. Эксперимент по своим результатам сходен с известным опытом восстановления гидроксида меди(П) глюкозой. Но в данном случае используют неорганический восстановитель – гидросульфит натрия. Как же объяснить полученные результаты?
Возникающая при проведении опыта проблемная ситуация требует от учащихся выдвижения достоверной гипотезы. Они должны предположить, что сначала протекает обменная реакция между раствором сульфата меди(Н) и раствором щелочи, но так как в пробирке находится еще восстановитель – гидросульфит натрия, то протекает и окислительно-восстановительная реакция. Получающийся в ходе эксперимента гидроксид меди(П) сразу восстанавливается, поэтому выпадает не синий осадок, а желтый. Нагревание полученного осадка способствует его разложению с образованием темно-красного оксида меди(Г).
Учитель подтверждает гипотезу и предлагает учащимся составить уравнения последовательно протекающих химических реакций:
|
|
|

Сравнение данного эксперимента с опытом по восстановлению гидроксида меди(П) глюкозой, который обычно проводится в курсе органической химии, позволяет сделать вывод, что разные по своей природе восстановители – глюкоза (органический восстановитель) и гидросульфит натрия (неорганический восстановитель) – могут сходным образом взаимодействовать при нагревании с гидроксидом меди(П), восстанавливая этот гидроксид.
Опыт 2. Восстановление серебра раствором гидросульфита натрия
Реактивы и оборудование: аммиачный раствор оксида серебра, раствор гидросульфита натрия, 2%-ный раствор едкого натра; пробирки, спиртовка, водяная баня.
Выполнение опыта. В пробирку, предварительно подготовленную для проведения реакции «серебряного зеркала» (обезжиренную и пропаренную), наливают раствор аммиаката серебра, затем добавляют по 2–3 капли раствора щелочи и раствора гидросульфита натрия. Пробирку нагревают на водяной бане. Наблюдают образование на стенках пробирки серебра в виде зеркального налета.
Обсуждение опыта и вывод. Восстановление серебра происходит примерно так же, как и в опыте с глюкозой. Необычность протекания реакции с гидросульфитом натрия создает проблемную ситуацию. Поиск ее решения учащиеся могут осуществлять уже самостоятельно, опираясь на сведения, полученные при обсуждении эксперимента по восстановлению гидроксида меди(Н).
Проведенный эксперимент доказывает уже на другом примере проявление гидросульфитом натрия восстановительных свойств.
Уравнение реакции можно составить в двух вариантах.
Первый вариант – упрощенный:

В случае если учащиеся имеют необходимую предварительную подготовку, уравнение составляют в более точной форме:

После обсуждения и составления уравнений реакций делают вывод о том, что гидросульфит натрия – достаточно сильный неорганический восстановитель.
Опыт 3. Взаимодействие гидросульфита натрия с иодом
Реактивы и оборудование: раствор гидросульфита натрия, раствор иода; пробирки.
Выполнение опыта. В пробирку с разбавленным водой спиртовым раствором иода прибавляют раствор гидросульфита натрия. Окраска раствора иода сразу изменяется, он становится бесцветным.
|
|
|
Обсуждение опыта и вывод. Моментальное изменение цвета раствора иода означает, что иод сразу окисляет гидросульфит натрия и в ходе реакции образуются новые бесцветные соединения. Возникает проблемный вопрос: почему скорость данной химической реакции очень большая? От учащихся требуется также правильно составить уравнение наблюдаемой реакции, учитель предлагает им ответить на поставленные вопросы самостоятельно.
Анализируя ход протекающей реакции, учащиеся должны выдвинуть предположение о том, что в этом эксперименте иод проявляет по отношению к гидросульфиту натрия сильные окислительные свойства. Гипотезу учащихся подтверждает учитель и дополнительно разъясняет, что такие сильные окислители, как галогены, очень легко и быстро окисляют гидросульфиты, в отличие, например, от кислорода, который окисляет их медленно и постепенно.
На этом свойстве – легком окислении гидросульфитов галогенами – основано применение гидросульфита натрия в промышленности в качестве «антихлора» (средства для удаления хлора из отбеленных тканей).
Составляют уравнение протекающей реакции:

Затем делают вывод: сильные окислители легко окисляют гидросульфит натрия до высшей степени окисления атомов серы (+6).
Опыт 4. Окисление гидросульфита натрия перманганатом калия
Реактивы и оборудование: раствор гидросульфита натрия, разбавленный раствор перманганата калия, 10%-ный раствор серной кислоты; пробирки.
Выполнение опыта. В пробирку с раствором перманганата калия сначала добавляют раствор серной кислоты для создания кислотной среды. Затем к подкисленному раствору перманганата калия добавляют раствор гидросульфита натрия. Красно-фиолетовая окраска раствора сразу изменяется: он становится бесцветным.
Обсуждение опыта и вывод. Как и в предыдущем эксперименте, изменение цвета раствора окислителя происходит очень быстро. Учащимся объясняют, что для эффектного протекания реакции к раствору перманганата калия добавляют раствор серной кислоты, поскольку в кислой среде перманганат калия проявляет окислительные свойства наиболее сильно. Сравнивая протекание реакций в этом и предыдущем опытах, учащиеся убеждаются, что и с другим сильным окислителем – перманганатом калия – реакция протекает с большой скоростью.
|
|
|
В этом случае проблема будет заключаться в правильном составлении уравнения реакции. Учитель разъясняет, что в кислотной среде перманганат-ион восстанавливается до Mn2+. Об этом свидетельствует обесцвечивание раствора перманганата калия. Если бы реакция протекала в другой среде, то по-другому изменялся бы и цвет раствора: в щелочной среде – до зеленой окраски вследствие образования манганата калия, а в нейтральной среде выпал бы осадок оксида марганца (IV) бурого цвета.
Далее учащиеся могут самостоятельно составить уравнение наблюдаемой реакции:

Делается вывод: поскольку перманганат калия в кислотной среде сильный окислитель, реакция окисления гидросульфита натрия протекает очень легко.
Опыт 5. Окисление гидросульфита натрия хлоридом железа(Ш)
Реактивы и оборудование: раствор гидросульфита натрия, 10%-ный раствор хлорида железа; пробирки, спиртовка.
Выполнение опыта. В пробирку с раствором хлорида железа добавляют раствор гидросульфита натрия. Интенсивность окраски раствора значительно возрастает. При нагревании полученного раствора цвет постепенно изменяется: сначала окраска ослабевает, а затем раствор становится бесцветным.
Обсуждение опыта и вывод. Выполнение этого эксперимента ставит перед учащимися следующие проблемы.
• Почему не происходит сразу обесцвечивание раствора окислителя, ведь хлорид железа достаточно сильный окислитель?
• Почему в начале опыта окраска раствора значительно усиливается?
• Почему желтовато-коричневая окраска раствора хлорида железа исчезает только при нагревании?
Ответы на эти вопросы могут быть получены при проведении эвристической беседы с учащимися. В самом начале выполнения опыта они могли предположить, что данный окислитель не окисляет гидросульфит натрия, поскольку окраска раствора хлорида железа(Ш) при окислении должна ослабевать. Усиление окраски раствора до темно-коричневой приводит их в недоумение. И только нагревание раствора, сопровождающееся ослабеванием окраски и последующим ее исчезновением, вносит определенные коррективы в рассуждения учащихся.
Для получения правильных ответов на все возникшие вопросы необходимо, чтобы учащиеся актуализировали свои знания из разных разделов курса химии.
Повышение интенсивности окраски раствора означает, что сначала происходит смещение равновесия гидролиза соли в сторону его усиления:
|
|
|

Растворы солей железа, подвергшихся значительному гидролизу, окрашены в темно-коричневый цвет. Значит, в начале опыта при добавлении к раствору хлорида железа раствора гидросульфита натрия идет не окислительно-восстановительная реакция, а преимущественно гидролиз соли. При нагревании раствора между этими двумя веществами протекает окислительно-восстановительный процесс, так как нагревание способствует усилению окислительных свойств хлорида железа.
Уравнение протекающей окислительно-восстановительной реакции:

В завершение обсуждения формулируется вывод: хлорид железа (III) окисляет гидросульфит натрия только при нагревании, поскольку при этом условии его окислительная способность более высокая.
|
|
|


