 |
Окислительные свойства гидросульфита натрия
|
|
|
|
Опыт 6. Окисление сульфата железа(П) гидросульфитом натрия
Реактивы и оборудование: раствор гидросульфита натрия, 10%-ный раствор сульфата железа, раствор гексацианоферрата(И) калия; пробирки.
Выполнение опыта. В пробирку с 3 мл раствора гидросульфита натрия постепенно добавляют бесцветный раствор сульфата железа(И) до появления желтовато-коричневой окраски, характерной для растворов солей железа. С целью подтверждения образования сульфата железа(Ш) к полученному раствору добавляют несколько капель раствора гексацианоферрата калия. Выпадает в осадок малорастворимая соль синего цвета – берлинская лазурь.
Обсуждение опыта и вывод. Проведение данного опыта ставит перед учащимися новую проблему. Выясняется, что гидросульфит натрия вступает во взаимодействие не только с солью железа, но и с солью железа. Изменение цвета раствора на желто-коричневый в опыте с раствором соли железа и подтверждение образования соли железа(Ш) в результате реакции означают, что происходит процесс окисления соли железа(И).
Какую же роль играет в этом эксперименте гидросульфит натрия? Учащиеся приходят к выводу, что в данной реакции гидросульфит натрия выступает окислителем.
В предыдущих опытах гидросульфит натрия проявлял свойства восстановителя, легко окисляясь сильными окислителями (иод, перманганат калия и др.). Новый проблемный эксперимент показывает, что гидросульфит натрия может проявлять противоположные свойства – окислителя.
Учащиеся должны обратить внимание на то, что степень окисления атомов серы в гидросульфите натрия – промежуточная между высшей и более низкими значениями. Следовательно, если подобрать для химической реакции определенный восстановитель, то гидросульфит натрия может проявить в ходе нее и свойства окислителя.
|
|
|
После этого обсуждения учитель предлагает учащимся составить уравнение протекающей реакции. Сделать это им будет непросто, но разъяснение учителя, что восстановление серы гидросульфита натрия происходит до образования ее в мелкодисперсном виде, даст правильное направление рассуждениям.
Учащиеся составляют уравнение реакции:
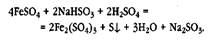
Составляется также уравнение реакции, подтверждающее образование соли железа(Ш):

Теперь можно сделать вывод: гидросульфит натрия в водном растворе может проявлять свойства не только сильного восстановителя, но и окислителя.
Опыт 7. Окисление иодида калия гидросульфитом натрия
Реактивы и оборудование, раствор гидросульфита натрия, 10%-ный раствор иодида калия, 10%-ный раствор серной кислоты; пробирки.
Выполнение опыта. В пробирку с раствором иодида калия добавляют немного раствора серной кислоты (для подкисления) и затем раствор гидросульфита натрия. Наблюдают появление желтовато-коричневой окраски вследствие выделения иода.
Опыт можно провести и так. В пробирку с 3 мл раствора гидросульфита натрия добавляют смесь растворов иодида калия и серной кислоты. Полученный раствор приобретает желтовато-коричневую окраску.
Обсуждение опыта и вывод. Данный эксперимент снова ставит проблему и позволяет уже на другом примере проверить сделанный в предыдущем опыте вывод. Поскольку проведение нового проблемного опыта доказывает, что иодид калия окисляется с образованием иода, то учащиеся уже могут предсказать роль гидросульфита натрия в этом эксперименте.
При обсуждении опыта отмечают, что, как и сульфат железа(П), иодид калия можно использовать в качестве восстановителя в реакциях с гидросульфитом натрия.
На основе этих рассуждений учащиеся делают вывод, что в проведенной реакции с иодидом калия гидросульфит натрия выступает окислителем.
|
|
|
Уравнение реакции составляют по аналогии с предыдущим примером:

После проведения всех проблемных опытов учащиеся могут самостоятельно сделать обобщающий вывод, опирающийся на экспериментальные и теоретические данные гидросульфит натрия в водном растворе проявляет достаточно ярко выраженные кислотные свойства, он может выступать в роли сильного восстановителя, а в некоторых случаях – окислителя.
Литература
1. Габриелян О.С., Краснова В.Г. Компетентностный подход в обучении химии. // Химия в школе. – 2007.– №2
2. Герус С.А., Пустовит С.О. Методика формирования компетенций: опыт, теория, перспективы. // Химия в школе. – 2007.– №10
3. Трофимова И.В. Проблемы проблемного обучения. // Химия в школе. – 2005. – №6.
4. Сурин Ю.В. Развивающий эксперимент: программное обеспечение школьного курса. // Химия в школе. – 1998. – №5.
5. Сурин Ю.В. Методика проведения проблемных опытов по химии. – М.: Школа-Пресс, 1998.
6. Сурин Ю.В. Проблемно-развивающий эксперимент в обучении химии. // Химия в школе. – 2005.– №5
7. Шалашова М.М. Ключевые компетенции учащихся: проблема их формирования и измерения. // Химия в школе. – 2008. – №10.
8. Шаталов М.А. О способах решения учебных проблем. // Химия в школе. – 2002. – №8.
|
|
|


