 |
Взаимодействие с сильными основаниями.
|
|
|
|
 СН3СОО Н + КОН СН3СООК + Н2О
СН3СОО Н + КОН СН3СООК + Н2О
Ацетат калия
 НООС-СОО Н + КОН НООС-СООК + Н2О
НООС-СОО Н + КОН НООС-СООК + Н2О
Щавелевая кислота гидроксалат калия (кислая соль)
 Н ООС-СОО Н + 2КОН КООС-СООК + 2Н2О
Н ООС-СОО Н + 2КОН КООС-СООК + 2Н2О
Оксалат калия (средняя соль)
Оксалат кальция – нерастворимая соль – основа некоторых видов почечных камней.
2. Реакции нуклеофильного замещения ЅN.
· Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых кислот со спиртами. Механизм:

Примеры уравнений:

 СН3СО ОН + С2Н5О Н Н2ЅО4 СН3СОО С2Н5+ Н2О
СН3СО ОН + С2Н5О Н Н2ЅО4 СН3СОО С2Н5+ Н2О
Этилацетат
 НООС-СО ОН + С2Н5О Н НООС-СОО С2Н5+ Н2О
НООС-СО ОН + С2Н5О Н НООС-СОО С2Н5+ Н2О
Этилгидроксалат
 НО ОС-СО ОН + 2С2Н5О Н С2Н5 ООС-СОО С2Н5 + 2Н2О
НО ОС-СО ОН + 2С2Н5О Н С2Н5 ООС-СОО С2Н5 + 2Н2О
Диэтилоксалат
· Образование амидов при взаимодействии с аммиаком.


 СН3СОО Н + NН3 СН3СОО- NН4+ t СН3СОNН2 + Н2О
СН3СОО Н + NН3 СН3СОО- NН4+ t СН3СОNН2 + Н2О
Ацетат аммония ацетамид
С первичными и вторичными аминами образуются N-замещенные амиды.
 НСООН + СН3 NН2 НСО- NН- СН3 + Н2О
НСООН + СН3 NН2 НСО- NН- СН3 + Н2О
N-метилформамид
· Образование галогенангидридов. Взаимодействие с хлоридами фосфора (III) и (V), тионилхлоридом.
 С6Н5СООН + РСl5 С6Н5СОСl + РОСl3 + НСl
С6Н5СООН + РСl5 С6Н5СОСl + РОСl3 + НСl
Бензойная кислота бензоилхлорид фосфорилхлорид
 СН3СООН +ЅОСl2 СН3СОСl + ЅО2 + НСl
СН3СООН +ЅОСl2 СН3СОСl + ЅО2 + НСl
Тионилхлорид ацетилхлорид
· Образование ангидридов кислот.
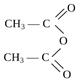
 2СН3СОО Н + Р2О5 + 2НРО3
2СН3СОО Н + Р2О5 + 2НРО3
Уксусная кислота
Уксусный ангидрид
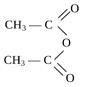
 СН3СОСl + NаООС- СН3 + NаСl
СН3СОСl + NаООС- СН3 + NаСl
Ацетилхлорид (нуклеофил)
уксусный ангидрид- используется для получения искусственны волокн, б/ц жидкость с резким запахом, не смешивается с водой.
3. Декарбоксилирование
 СН3 СООNа + NаО Н t СН4 + Nа2СО3
СН3 СООNа + NаО Н t СН4 + Nа2СО3
Ди – и трикарбоновые кислоты декарбоксилируются легче, с образованием монокарбоновых кислот и углекислого газа. Реакции многих биохимических процессов.
 Н ООС -СООН 200 С Н-СООН + СО2 (лаб способ получения муравьиной кислоты)
Н ООС -СООН 200 С Н-СООН + СО2 (лаб способ получения муравьиной кислоты)
|
|
|
Щавелевая кислота муравьиная кислота
 Н ООС -СН2-СООН 150 С СН3СООН + СО2
Н ООС -СН2-СООН 150 С СН3СООН + СО2
малоновая кислота уксусная кислота
 По мере удлинения углеродной цепи и удаления карбоксильных групп ослабевает их взаимное влияние, т.к. затухает – I -эффект. Поэтому следующие две кислоты не декарбоксилируются, а отщепляют молекулу воды с образованием циклических ангидридов.
По мере удлинения углеродной цепи и удаления карбоксильных групп ослабевает их взаимное влияние, т.к. затухает – I -эффект. Поэтому следующие две кислоты не декарбоксилируются, а отщепляют молекулу воды с образованием циклических ангидридов.
 Н ООС-СН2-СН2-СО ОН 220 С + Н2О
Н ООС-СН2-СН2-СО ОН 220 С + Н2О
янтарный ангидрид
4. Галогенирование насыщенных алифатических кислот.
Замещение водорода идет по α-атому углерода.
 СН3-СН(СН3)-СН2-СООН + Вr2 Р красный СН3-СН(СН3)-СНВr –СООН + НВr
СН3-СН(СН3)-СН2-СООН + Вr2 Р красный СН3-СН(СН3)-СНВr –СООН + НВr
Изовалериановая кислота 2-бромо-3метилбутановая кислота
На закрепление выполните вопросы после параграфа: уравнения на химические свойства кислот и их получение, а также цепочка превращения. Не забывайте называть вещества, указывать условия реакции и тип, механизм реакции.
За 3.02.2016.
Сложные эфиры. Амиды кислот. Свойства. Представители.
Стр. 190-199 вопросы 11.8-11.11, 11.31, 11.32
1. Общие сведения.
Функциональными производными называют производные карбоновых кислот, у которых ОН- группа замещена нуклеофильной частицей Х.
Общая формула R-СО-Х
R-СО-Сl (R-С=О)2О R-СОО- R1 R-СО-NН2
Хлороангидриды ангидриды сложные эфиры амиды
Производные карбоновых кислот, как и сами кислоты, вступают в реакции нуклеофильного замещения с образованием других функциональных производных. Нуклеофильное замещение проходит у sp2 –гибридного атома углерода.
Часть молекулы карбоновый кислоты без гидроксильной группы называется ацильным остатком. В систематической номенклатуре название ацильных остатков сочетание –овая кислота заменяется суффиксом –оил. Тривиальные названия связаны с латинским названием соответствующих кислот
R-СО- ацил СН3-СО- ацетил Н-СО- формил С6Н5-СО- бензоил
В результате взаимодействия карбоновых кислот или их функциональных производных с другими органическими соединениями (спиртами, аминами, аммиаком и т.д), в молекулы этих соединений вводятся ацильные остатки – реакции ацилирования ЅN.
|
|
|
 СН3-СООН + СН3ОН СН3-СО СН3 + Н2О (этерификация, ацилирование спиртов) метилацетат (метиловый эфир уксусной кислоты)
СН3-СООН + СН3ОН СН3-СО СН3 + Н2О (этерификация, ацилирование спиртов) метилацетат (метиловый эфир уксусной кислоты)
 СН3-СООН + NН2СН3 СН3-СО -NН -СН3 + Н2О (ацилирование аминов)
СН3-СООН + NН2СН3 СН3-СО -NН -СН3 + Н2О (ацилирование аминов)
N-метилацетамид (N-метилэтанамид; N-метиламид уксусной к.)
 СН3-СОСl + 2NН3 СН3-СО NН2 + NН4Сl (ацилирование аммиака)
СН3-СОСl + 2NН3 СН3-СО NН2 + NН4Сl (ацилирование аммиака)
Ацетамид (этанамид; амид уксусной кислоты)
Функциональные производные кислот способны гидролизоваться в соответствующие карбоновые кислоты.
 R-СО-Х + Н2О R-СООН + НХ
R-СО-Х + Н2О R-СООН + НХ
2. Сложные эфиры.
В систематических названиях сложных эфиров к названию углеводородного радикала спирта добавляют систематическое название карбоновой кислоты, при этом сочетание –овая кислота заменяют суффиксом –оат.
СН3СН2СООСН3 метилпропаноат (метилпропионат; метиловый эфир пропановой к.)
С6Н5СООСН(СН3)2 изопропилбензоат (изопропиловый эфир бензойной кислоты)
(СН3)2СНСН2СООС2Н5 этил-3-метилбутаноат (этил-3-метилбутират)
Как можно получить сложные реакции? Реакцией этерификации.
 НСООН + С2Н5ОН НСОО С2Н5 + Н2О (ЅN)
НСООН + С2Н5ОН НСОО С2Н5 + Н2О (ЅN)
Этилметаноат (этилформиат)- ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы придать ему характерный аромат; применяют в производстве витаминов B1, A, E.
 НСООН + С6Н5СН2ОН НСООСН2С6Н5 + Н2О
НСООН + С6Н5СН2ОН НСООСН2С6Н5 + Н2О
Бензиловый спирт бензилформиат - имеет запах жасмина; используется как растворитель лаков и красителей.
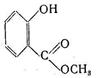

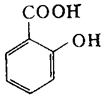
 + СН3ОН + Н2О
+ СН3ОН + Н2О
Салициловая кислота метилсалицилат – обезболивающие средство (в настоящее время вытеснен более эффективными средствами)
Реакции ацилирования спиртов хлорангидридами и ангидридами кислот ЅN.
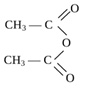
 + С8Н17ОН СН3-СОО С8Н17 + СН3-СООН
+ С8Н17ОН СН3-СОО С8Н17 + СН3-СООН
н-октилацетат – имеет запах апельсинов.
Уксусный ангидрид
 СН3СН2СН2СОСl + С2Н5ОН СН3СН2СН2СОО С2Н5 + НСl
СН3СН2СН2СОСl + С2Н5ОН СН3СН2СН2СОО С2Н5 + НСl
бутирилхлорид Этилбутират – запах ананасов.
(хлорангидрид бутановой кислоты)
Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости плохо растворимы в воде и хорошо – в большинстве органических растворителях. Многие сложные эфиры имеют приятный запах, они на ряду с другими веществами обусловливают запах цветов, фруктов и ягод. В пищевой промышленности на основе сложных эфиров созданы искусственные ароматизаторы. Многие используются в медицине в качестве лекарственных средств.
|
|
|
Сложные эфиры хорошо гидролизуются до исходных веществ в кислой и щелочной среде. Щелочной гидролиз эфиров называется – омылением.


 СН3СООС2Н5 + Н2О Н+ СН3СООН + С2Н5ОН
СН3СООС2Н5 + Н2О Н+ СН3СООН + С2Н5ОН
СН3СООС2Н5 + КОН СН3СООК + С2Н5ОН
Назовите вещества!
3. Амиды.
Амиды широко распространены в природе. Пептиды, белки содержат многочисленные амидные группировки. Также используются в медицине (лекарственные средства)
|
|
|


