 |
Кислотные и основные свойства одноатомных спиртов.
|
|
|
|
· Как кислоты взаимодействуют с щелочными металлами и их гидридами с образованием алкоксидов или алкоголятов.
 2СН3ОН + 2Nа 2СН3ОNа + Н2 метоксид натрия (метилат натрия)
2СН3ОН + 2Nа 2СН3ОNа + Н2 метоксид натрия (метилат натрия)
 С2Н5ОН + NаН С2Н5ОNа + Н2 этоксид натрия (этилат натрия)
С2Н5ОН + NаН С2Н5ОNа + Н2 этоксид натрия (этилат натрия)

 СН3СН2СН2ОН + КОН СН3СН2СН2ОК + Н2О (пропоксид калия)
СН3СН2СН2ОН + КОН СН3СН2СН2ОК + Н2О (пропоксид калия)
Безводные щелочи реагируют обратимо, водные растворы щелочей алкоголяты не образуют, равновесие смещается влево. Спирты являются слабыми кислотами
· Основные свойства тоже выражены слабо. Взаимодействуют с сильными и безводными кислотами с образованием неустойчивых алкилоксониевых солей, которые разлагаются в присутствии воды.



 С2Н5ОН + НСl [С2Н5О+-Н] Сl- Н2О С2Н5 Сl
С2Н5ОН + НСl [С2Н5О+-Н] Сl- Н2О С2Н5 Сl
этилоксонийхлорид Н
2. Реакции нуклеофильного замещения ЅN.
· С галогенопроизводными кислотами, галогенидами фосфора (III) и (V), тионилхлоридом.
 С2Н5ОН + НСl(конц) t С2Н5Сl + Н2О
С2Н5ОН + НСl(конц) t С2Н5Сl + Н2О


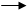 СН3СН2 – ОН + Н+ [СН3СН2 О+НН] Сl- СН3СН2-Сl + Н2О
СН3СН2 – ОН + Н+ [СН3СН2 О+НН] Сl- СН3СН2-Сl + Н2О
Основание кислота этилоксониевый ион этилхлорид уход.группа
Задание 5.11
· Получение простых эфиров из алкоголятов и галогенопроизводных

 СН3ОН + Nа -Н2 СН3ОNа (метоксид) + СН3СН2-Сl СН3ОС2Н5 + NаСl
СН3ОН + Nа -Н2 СН3ОNа (метоксид) + СН3СН2-Сl СН3ОС2Н5 + NаСl
Задание 5.12 Напишите схему реакции получения метилпропилового эфира исходя из хлорметана.
· Межмолекулярная дегидратация спиртов.
 2 С2Н5ОН Н2ЅО4, 140 С С2Н5О С2Н5
2 С2Н5ОН Н2ЅО4, 140 С С2Н5О С2Н5
Задание 5.13 Напишите схему межмолекулярной дегидратации изопропилового спирта.
Реакции элиминирования – Е - дегидратация.
 С2Н5ОН Н2ЅО4, 170 С СН2= СН2 + Н2О
С2Н5ОН Н2ЅО4, 170 С СН2= СН2 + Н2О
Задание 5.14. Напишите схему внутримолекулярной дегидратации 2-метилпропанола-2
4. Реакции окисления. Первичные спирты окисляются в альдегиды и далее в карбоновые кислоты. Вторичные спирты окисляются в кетоны.

 СН3СН2ОН [О] СН3СНО [О] СН3СООН
СН3СН2ОН [О] СН3СНО [О] СН3СООН
 СН3СНОН СН3 [О] СН3СО СН3
СН3СНОН СН3 [О] СН3СО СН3
|
|
|
[О] – хромовая смесь, перманганат калия в кислой среде.
5. Качественные реакции на спирты. Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных реакции различны.
· Простейшая качественная реакция на спирты — окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
CH3-CH2-OH + CuO —t—> CH3-CHO + Cu + H2O
· Спирты идентифицируются пробой Лукаса — конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида:
CH3-CHOH-CH3 + HCl —ZnCl2—> CH3-CHCl-CH3↓ + H2O
Первичные спирты в реакцию не вступают.
· Еще одним известным методом является иодоформная проба:
CH3-CH2-OH + 4I2 + 6NaOH ——> CHI3↓ + 5NaI + HCOONa + 5H2O
За 4.02.2016
Многоатомные спирты. Свойства, применение.
Стр. 150-154 задания 5.15-5.20
1. Получение многоатомных спиртов. Получают теми же способами, что и одноатомные спирты.
Задание 5.15 Напишите схему реакции взаимодействия 1,3-дибромобутана с водным раствором гидроксида натрия. Опишите механизм реакции и назовите продукт реакции.
Задание 5.16 Напишите реакцию окисления бутена-2 (реакция Вагнера).
В промышленности получают гидролизом эпоксидов.


 СН2 – СН2 + Н2О Н+ СН2ОН-СН2ОН
СН2 – СН2 + Н2О Н+ СН2ОН-СН2ОН
О этиленоксид этиленгликоль
2. Химические свойства.
Для двух- и трехатомных спиртов характерны все реакции одноатомных спиртов. Напишите уравнение реакции:
1) Этиленгликоль с натрием
2) Этиленгликоль с тионилхлоридом
3) Этиленгликоль с 1 моль хлорметенам
4) Качественная реакция на многоатомные спирты.
Благодаря наличию нескольких гидроксильных групп, многоатомные спирты проявляют более кислотные свойства, из-за отрицательного индуктивного эффекта ОН-рупп. Поэтому многоатомные спирты реагируют со щелочами, образуя соли. Соли двухатомных спиртов называются гликолятами, а трехатомных – глицератами. В гликолях можно заместить один или два атома водорода гидроксильных групп на атомы металлов. При взаимодействии гидроксида меди с многоатомными спиртами образуются комплексные соединения синего цвета – качественная реакция на многоатомные спирты.
|
|
|

Задание 5.17
3. Представители спиртов
Стр. 152. Формула, физиологическое действие, применение
Задания 5.19, 5.20
|
|
|


