 |
Не забывайте называть вещества, указывать условия реакции и тип, механизм реакции
|
|
|
|
За 5.02.2016
Фенолы. Классификация, номенклатура, способы получения и химические свойства фенолов. Качественные реакции на фенолы.
Стр. 154-163 задания 5.22-5.26
1. Фенолы – производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены гидроксильными группами.
2. По числу гидроксильных групп: одно-, двух- и трехзамещенные. Запишите примеры фенолов. Работа с учебником с. 156.










 Одноатомные.
Одноатомные.




 ОН ОН ОН СН3 ОН
ОН ОН ОН СН3 ОН
 СН3 СН3
СН3 СН3
Фенол (карболовая к) о-крезол (2-метилфенол) м-крезол п-крезол



 СН3 ОН NО2 ОН
СН3 ОН NО2 ОН






 СН(СН3)2 NО2
СН(СН3)2 NО2
NО2
Тимол (2-изопропил-5-метилфенол) пикриновая кислота (2,4,6-тринитрофенол)
Двухатомные.

 ОН ОН
ОН ОН








 ОН ОН
ОН ОН
 ОН
ОН
Пирокатехин (1,2-дигидроксибензол) ОН гидрохинон
Резорцин 1,,3-дигидроксибензол)
Трехатомные




 ОН НО
ОН НО


 ОН ОН
ОН ОН
 |  |
ОН пирогаллол ОН флороглюцин
(1,2,3-тригидроксобензол) (1,3,5-тригидроксобензол)
Одноатомные фенолы – кристаллические вещества, реже жидкости с сильным характерным запахом. Все фенолы обладают низкой летучестью из-за высокой прочности водородных связей. Фенолы относятся к токсичным веществам.
3. Способы получения.
· Фенол и его низшие гомологи выделяют из продуктов переработки каменного угля и нефти.
· «Щелочной плав» - Щелочное плавление ароматических сульфоновых кислот (натриевых или калиевых)

Задание 5.22
· Кумольный способ – бензол алкилируют пропеном с образованием кумола, кумол окисляют кислородом при 90-130о до гидропероксида, а затем разлагают при 50о серной разбавленной кислотой до фенола и ацетона.

· Получение из анилина – диазотирование анилина и его производных с последующим разложением солей диазония.
|
|
|
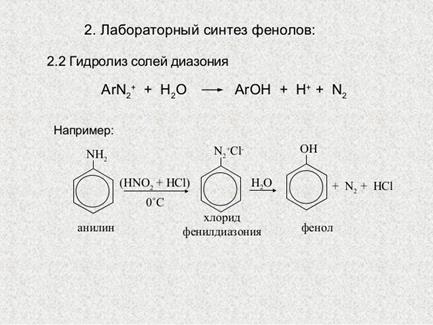
4. Химические свойства
· Кислотные свойства
Фенолы проявляют более сильные кислотные свойства, чем спирты. Поэтому они могут взаимодействовать с водными растворами щелочей.
 С6Н5-ОН + КОН С6Н5-ОК + Н2О феноксид калия (фенолят)
С6Н5-ОН + КОН С6Н5-ОК + Н2О феноксид калия (фенолят)
Феноляты устойчивы к гидролизу, но при пропускании через раствор углекислого газа превращается в свободный фенол. Эта реакция доказывает, что фенол более слабая кислота, чем угольная кислота.
 С6Н5-ОК + Н2О + СО2 С6Н5-ОН + КНСО3
С6Н5-ОК + Н2О + СО2 С6Н5-ОН + КНСО3
Задание 5.23 Какое соединение – тимол или фенол – является более сильной кислотой и почему?
· Основные свойства – очень низкие, поэтому фенолы не образуют солей даже с сильными минеральными кислотами
· Реакции нуклеофильного замещения ЅN.
По причине низкой нуклеофильности, в реакциях нуклеофильного замещения используются не сами фенолы, их соли – феноляты. Реакция с галогеноалканами с образованием простых эфиров.
 С6Н5-О-К+ + СН3-С+Н2Вr СН3-СН2-О- С6Н5 + КВr
С6Н5-О-К+ + СН3-С+Н2Вr СН3-СН2-О- С6Н5 + КВr
Не взаимодействуют с карбоновыми кислотами, не замещается на галоген в реакциях с галогеноводородами.
Задание 5.24 Напишите реакцию взаимодействия 1-иодопропана с феноксидом натрия.
Ацилирование фенолов.
 С6Н5-ОН + СН3-СОСl С6Н5-ООС-СН3 + НСl
С6Н5-ОН + СН3-СОСl С6Н5-ООС-СН3 + НСl
Хлорангидрид уксусной кислоты фенилацетат
Задание 5.25
· Реакции ароматического кольца.
Взаимное влияние гидроксильной группы и ароматического кольца.
+М > -I о- и п- положения заместителей. Фенолы значительно активнее в реакциях электрофильного замещения, чем бензол.
Галогенирование. Реакция с бромной водой используется для качественного обнаружения фенола.



Нитрование. Нитруется даже на холоду разбавленной азотной кислотой с образованием о- и п- изомеров нитрофенолов, выход составляет 40 %. Чтобы получить пикриновую кислоту, фенол сначала сульфируют, а потом нитруют в жестких условиях.


Задание 5.26
· Реакции окисление
|
|
|
Фенолы легко окисляется даже кислородом воздуха

· Качественная реакция с хлоридом железа (III) – фенол и резорцин – окраска сине-фиолетовая, пирокатехин и гидрохинон дают зеленое окрашивание.

Не забывайте называть вещества, указывать условия реакции и тип, механизм реакции.
За 5.02.2016
|
|
|


