 |
Строение атома. Опыты Резерфорда. Постулаты Бора. Теория атома водорода.
|
|
|
|
До Резерфорда было установлено, что атом нейтрален, в его состав входят электроны, следовательно, должен содержаться также положительный заряд. Целью опытов Резерфорда – установить строение атомов. Выделяемый, с помощью узкого отверстия в свинцовом контейнере пучок альфа-частиц (ядер атома гелия 2He4), испускаемых радиоактивным источником, падал на тонкую металлическую фольгу. При прохождении через фольгу альфа-частицы отклонялись от первоначального направления движения на различные углы. Рассеянные альфа-частицы ударялись об экран, покрытый сернистым цинком, и вызываемые ими вспышки света наблюдались в микроскоп. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр фольги, и устанавливать под любым углом. Весь прибор помещался в вакуумную камеру, чтобы устранить рассеяние альфа-частиц за счет столкновения с молекулами воздуха.
Были установлены следующие факты:
1) Основная часть альфа частиц отклоняется от первоначального направления на небольшие углы,
2) угол рассеяния небольшого количества альфа-частиц оказывается очень большим и может достигать 180о.
Из первого факта было ясно, что область, отклоняющая альфа-частицы, имеет малый размер (вероятность попадания в ее мала), из второго – что она имеет большую массу (иначе не было бы отражения таких тяжелых частиц как двукратно ионизированные атомы гелия). Основываясь на данных выводах Резерфорд предложил ядерную или планетарную модель атома. Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительно заряженное ядро, имеющее размеры до ~10-12 см, а вокруг ядра вращаются отрицательно заряженные электроны, суммарный заряд которых равен по модулю заряду ядра. Почти вся масса атома сосредоточена в ядре.
|
|
|
Данная экспериментально установленная модель атома оказалась в противоречии с классической электродинамикой. Электрон, двигаясь по искривленной траектории должен иметь центростремительное ускорение. По законам классической электродинамики заряд, движущийся с ускорением, должен непрерывно излучать электромагнитные волны. Процесс излучения сопровождается потерей энергии, так что электрон должен постепенно опускаться, двигаясь по спирали и, в конечном счете, за очень короткое время (~10-8 с), упасть на ядро. При этом, непрерывно изменяя радиус своей орбиты, он должен излучать сплошной спектр, но в опытах с разреженными газами установлено, что спектры атомов являются линейчатыми.
Выход из противоречия предложил Бор, который выдвинул следующие постулаты:
1) Из бесконечного множества электронных орбит, возможных для электрона в атоме с точки зрения классической механики, на самом деле реализуются лишь некоторые, называемые стационарными. Находясь на стационарной орбите электрон не излучает энергию (э/м волны) хотя и движется с ускорением. Для стационарной орбиты момент импульса электрона должен быть целым кратным от постоянной величины ( =h/2p– постоянная Дирака). Т.е. должно выполняться соотношение:
=h/2p– постоянная Дирака). Т.е. должно выполняться соотношение:
 (1)
(1)
где m – масса электрона, v –скорость электрона, r – радиус электронной орбиты, n – целое число, которое может принимать значения 1, 2, 3, 4…и называется главным квантовым числом.
2) Излучение испускается или поглощается атомом в виде светового кванта энергии hnпри переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний E n1 и E n2 , между которыми совершается квантовый скачок электрона:
 (2)
(2)
Такое же соотношение справедливо и для случая поглощения. Соотношение (2) называется правилом частот Бора.
|
|
|
Ранее, при проведении экспериментальных исследований спектров излучения водорода Бальмер установил, что атомы водорода (как и атомы других элементов) излучают электромагнитные волны строго определённых частот. Причем оказалось, что величину, обратную длине волны спектральной линии, можно достаточно точно рассчитать, по формуле которую он подобрал опытным путем (обобщенная формула Бальмера)
 (3)
(3)
где R – названа постоянной Ридберга, а n – целое число, которое может принимать ряд целых значений 1,2,3..., причем n1 < n2 Значение постоянной Ридберга, полученное экспериментально составило R=1,097373178 м-1.
Для объяснения линейчатого спектра излучения атомарного водорода Бор создал теория атома водорода (теория атома водорода Бора), в основу которой положил планетарную модель атома Резерфорда и уже упоминавшиеся выше постулаты. Из первого постулата Бора следует, что возможными являются лишь такие орбиты движения электрона вокруг ядра, для которых момент импульса электрона равен целому кратному от постоянной Дирака  (1). Далее Бор применил законы классической физики. В соответствии со вторым законом Ньютона, для электрона, вращающегося вокруг ядра, кулоновская сила играет роль центростремительной силы и должно выполняться соотношение:
(1). Далее Бор применил законы классической физики. В соответствии со вторым законом Ньютона, для электрона, вращающегося вокруг ядра, кулоновская сила играет роль центростремительной силы и должно выполняться соотношение:
 . (4)
. (4)
Исключая скорость из уравнений (1) и (4), было получено выражение для радиусов допустимых орбит:
 (5)
(5)
Здесь n – главное квантовое число (n = 1,2,3…).
Радиус первой орбиты водородного атома называется Боровским радиусом и равен
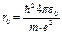 (6)
(6)
Численное значение Боровского радиуса составляет 0,0529 нм.
Внутренняя энергия атома равна сумме кинетической энергии электрона и потенциальной энергии взаимодействия электрона с ядром (ядро, ввиду его большой массы, в первом приближении считается неподвижным).

 (7)
(7)
Из формулы (4) легко получить следующую формулу
 . (8)
. (8)
Подставив (8) и выражение (5) в (7), найдём разрешённые значения внутренней энергии атома:
 (9)
(9)
где n = 1, 2, 3, 4…, 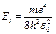 - энергия ионизации атома водорода (Ei =13,5 эВ)
- энергия ионизации атома водорода (Ei =13,5 эВ)
Диаграмма уровней энергии атома водорода изображена на рис.1.
При переходе атома водорода из состояния n1 в состояние n2 излучается фотон.
|
|
|
 (10)
(10)
Учитывая, что n=с/ λ, обратная длина волны испускаемого света может быть рассчитана по формуле:

Т.е. получена формула Бальмера (3). Здесь числа n1, n2 –это квантовые числа, являющиеся это номерами стационарных орбит между которыми происходит квантовый скачок электрона.
Водород в атомарном состоянии испускает линейчатый спектр, который можно разделить на спектральные серии. Спектральная серия представляет собой набор спектральных линий, для которых квантовое число n1 (номер уровня, на который осуществляются переходы со всех вышележащих уровней) имеет одинаковое значение. Существуют серия Лаймана (n1=1, ультрафиолетовая часть спектра), серия Бальмера (n1 = 2, видимая часть спектра), все остальные принадлежат к инфракрасной части спектра - серия Пашена (n1 = 3), серия Брекета (n1 = 4) серия Пфунда ( n1 = 5) и т.д. (рис.1.)
 | |||
Рис.2. Энергетический спектр атома водорода
|
|
|


