 |
Состав примесей природных вод.
|
|
|
|
Характеристика источников водоснабжения.
Воды подразделяются на: подземные (грунтовые, межпластовые, артезианские), поверхностные (реки, озера, каналы, водохранилища), атмосферные осадки.
По содержанию взв в-в: маломутные (М до 50 мг/л), средней мутности (М до 250 мг/л), мутные (М до 1500 мг/л), высокомутные (М более 1500 мг/л).
По цветности (по содержанию органич в-в и гумусовых соединений): малоцветные (Ц до 35 град), средней цветности (Ц до 120 град), высокой цветности (Ц более 120 град).
Окисляемость – содержание в воде органических соединений. Окисляемость – это количество О2, которое расходуется на окисление содержащихся в воде органических соединений. Перманганатная окисляемость ≤ 2 мг/л – вода повышенного качества.
Состав примесей природных вод.
Природная вода представляет собой многокомпонентную систему, в состав которой входят: газы, органич и мин в-ва, находящиеся в истинно растворенном, коллоидном и взвешенном состоянии, а также микроорганизмы.
1. Содержание в воде кислорода зависит от температуры и давления и находится в чистом виде в пределах до 14,6 мг/л. Чем больше t, тем меньше растворенного О2 в воде. Уменьшению содержания О2 в воде способствует коррозия труб.
2. Угольная кислота, растворенная в воде встречается в виде молекулы Н2СО3, растворенного газа СО2 в виде гидрокарбонатных НСО3- и карбонатных СО32-. Угольная кислота, растворенная в оде состоит из свободной угольной кислоты СО2 и связанной уг. к-ты Са(НСО3)2, СаСО3. Чем меньше рН, тем больше в воде содержания СО2 и угольной кислоты в виде Н2СО3. В поверхностных водах содержание угольной к-ты определяется растворимостью углекислого газа из воздуха и составляет до 20 мг/л. В подземных водах свободная угольная к-та появляется в результате процессов разложения органических соединений. Концентрация в подземных водах составляет до 2200 мг/л.
|
|
|
3. Содержание сероводорода Н2S встречается в подз источниках, образуется при разложении минеральных солей, т.е. гипса, серного колчедана. Н2S может появиться и в поверхностных источниках в результате протекания гнилостных процессов или в результате сброса в водоем неочищенных СВ. В зависимости от рН Н2S может быть в виде растворимого газа Н2S, гидросульфид ионов НS- или в виде сульфит ионов S2-.
4. Азот появляется в природных водах в результате разложения органических соединений, но в очень малых количествах. Растворимость азота в воде зависит от t, но она меньше, чем растворимость О2.
5. Метан СН4 встречается чаще в подземных водах в количестве до 30 мг/л. Образуется в результате разложения клетчатки под воздействием микробов.
6. Взвешенные в-ва могут проявляться в виде грубодисперсных частиц. Образуются в результате вымывания из пород глинистых частиц, гниения и разложения сине-зеленых водорослей в результате образуется соединения, которые называются коллоидами. По своему гранулометрическому составу взв в-ва различаются и характеризуются гидравлической крупностью U, мм/с – скорость осаждения частиц взвеси.
7. Содержание органических в-в в воде представляется в виде почвенного и торфяного гумуса – это органические вещества природного происхождения.
8. Ионы, содержащиеся в воде в большом количестве в виде катионов: Na+, K+, Mg2+, Ca2+, Fe2+, Fe3+; и анионов SO42-, Cl-, NO32-, S2- и др.
9. Содержание солей (минерализация природных вод). Общая минерализация – сумма катионов, анионов (мг/л). По солесодержанию воды: пресные (до 1 мг/л), минерализованные (1-25 мг/л), с морской соленостью (25-50 мг/л), рассолы (более 50 мг/л). На практике для проверки минерализации составляют балансовое уравнение: сумма концентраций катионов растворимых в воде должна быть равна сумме концентраций растворенных в воде анионов.
|
|
|
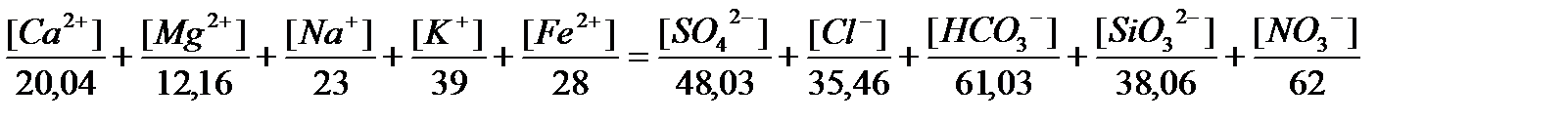
Сухой остаток – это количество мин солей и нелетучих органических соединений, которые остаются при выпаривании определенного объема воды.
Потери при прокаливании – это часть орг остатка в сухом остатке, которые улетучивается при прокаливании сухого остатка.
10. Жесткость и щелочность обусловлены наличием Ca2+ и Mg2+. Жесткость карбонатная обусловлена наличием в воде гидрокарбонатов Ca2+ и Mg2+. Жесткость некарбонатная: сульфаты, хлориды и силикаты Ca2+ и Mg2+. Жесткость общая – сумма карбонатной и некарбонатной жесткостей. Щ = Жк = Жобщ – Жнк.
11. Содержание железа в поверхностных водах в форме Fe3+ в количестве 0,3-0,5 мг/л, а в подземных водах Fe2+ в количестве от 3 до 20 мг/л.
12. Содержание токсических и радиоактивных в-в характеризуются следующим выражением:  , где С1, С2,.., Сn – содержание токсических или радиоактивных в-в в воде, мг/л; ПДК – предельно допустимая концентрация в-в.
, где С1, С2,.., Сn – содержание токсических или радиоактивных в-в в воде, мг/л; ПДК – предельно допустимая концентрация в-в.
13. Активная реакция воды рН = -lg[H+]. Если рН = 1-3 – кислые природные воды, 4-6 – слабокислые природные воды, 7 – нейтральные ПВ, 8-10 – слабощелочные ПВ, 11-14 – щелочные ПВ.
14. Азотсодержащие в-ва – это соли аммония NH4, нитриты, нитраты. Образуются в оде в результате восстановления нитритов и нитратов гумусовыми веществами, железом или в результате разложения белковых соединений, вносимых со СВ в водоем. Если в питьевой воде больше азотсодержащих в-в 50 мг/л, то это приводит к нарушению окислительной функции человека.
15. Содержание в воде кремния в виде кремниевой кислоты и поликремниевой кислоты.
16. Содержание в воде йода и фтора должно быть: I ≥ 10-8 мг/л, F ≈ 1 мг/л – во избежание заболеваний щитовидной железы.
|
|
|


