 |
Регулирование оптимальных условий коагуляции. Факторы, влияющие на процесс коагуляции.
|
|
|
|
На процесс коагуляции примесей воды оказывают влияние следующие факторы: концентрация ионов водорода в воде; щелочность; t; условия перемешивания; быстрота смешения коагулянта с водой; содержание в воде естественных взвесей; анионный состав воды; рН; доза коагулянта.
Коагулянты применяются в технологи водоподготовки чаще всего соли слабых оснований и сильных кислот. При их растворении происходит гидролиз, взаимодействие с ОН-, содержащемся в воде, в результате электролитической диссоциации воды эти соли образуют малорастворимые основания и раствор приобретает кислую реакцию среды. Гидролиз солей алюминия в качестве коагулянта, протекает в несколько стадий:  ,
, 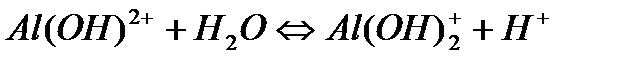 ,
,  .
.

Степень гидролиза увеличивается с разбавлением раствора и увеличения его t и рН. Гидроокись алюминия – амфотерное соединение, т.е. обладающее как кислотными так и основными свойствами.
В кислой среде:  ; константа равновесия
; константа равновесия  , т.к.
, т.к.  находится в тв фазе, то концентрация его в растворе постоянна и
находится в тв фазе, то концентрация его в растворе постоянна и  (1).
(1).
В щелочной среде  ; константа равновесия
; константа равновесия  , где
, где  - коэффициент ионного произведения воды.
- коэффициент ионного произведения воды.
 (2).
(2).
Гидролиз в кислой среде (1) прямопропорционален 3ей степени концентрации ионов Н+, а в щелочной среде (2) растворимость гидроокиси алюминия обратнопропорциональна концентрации H+.
Для быстрого и полного протекания процесса гидролиза коагулянта необходимо необходим некоторый щелочной резерв воды, т.е. наличие в воде определенного количества дикарбонат- и карбонатионов, которые связывают ионы водорода, выделяющегося при гидролизе. Одновременно избыток ионов Н+ прекращают гидролиз сульфат алюминия.
Если щелочной резерв недостаточен, то в воду дополнительно вводят известь или соду.
|
|
|
Доза подщелачивающего реагента определяется:  , если Дщ>0 – требуется подщелачивание воды.
, если Дщ>0 – требуется подщелачивание воды.
 Дк – доза коагулянта; ек – эквивалентная масса безводного коагулянта; Щ0 – минимальн щелочность воды; 1 – резервная остаточная щелочность; kщ – коэффициент для извести – 28, для соды – 53.
Дк – доза коагулянта; ек – эквивалентная масса безводного коагулянта; Щ0 – минимальн щелочность воды; 1 – резервная остаточная щелочность; kщ – коэффициент для извести – 28, для соды – 53.
Молекулы воды, а также частицы ее примеси, находящиеся в тепловом Броуновском движении, интенсивность которого I, прямопропорциональна t воды.
Процесс коагуляции во времени делится на 2 фазы: 1 – пирекинетическая фаза – после введения коагулянта нарушается агрегативная устойчивость частиц примеси, наступает процесс агломерации ионов при их контактировании. Вероятность соударения отдельных частиц и их агломерация зависит от скорости их перемещения, т.е. от Броуновского движения. Пирекинетическая фаза процесса коагулирования примесей воды заканчивается образованием первичных агрегатов. Для дальнейшего передвижения этих агрегатов энергии теплового Броуновского движения становится недостаточно. 2 – коагуляция связана с 4 фактором (условие перемешивания воды) – ортокинетическоя фаза, длится 60 и более минут, происходит слипание и формирование крупных, плотных хлопьев путем перемешивания воды в камерах хлопьеобразования. Интенсивность перемешивания должна обеспечивать максимально возможное контактирование отдельных агрегатов, но не должна вызывать разрушение хлопьев. Влияние быстроты смешения коагулянта с водой – правильный выбор смесителя, подбирается по производительности станции.
Влияние дозы коагулянта имеет первостепенное значение при коагулировании и иллюстрируется коагуляционной кривой.
 I – при малых дозах коагулянта эффекта осветления и обесцвечивания незначителен. Граница I-II – порог коагуляции. II – при увеличении дозы коагулянта, увеличивается эффект осветления и обесцвечивания. Граница II-III – оптимальная доза. III – увеличение дозы не дает заметного эффекта.
I – при малых дозах коагулянта эффекта осветления и обесцвечивания незначителен. Граница I-II – порог коагуляции. II – при увеличении дозы коагулянта, увеличивается эффект осветления и обесцвечивания. Граница II-III – оптимальная доза. III – увеличение дозы не дает заметного эффекта.
|
|
|
Под дозой коагулянта подразумевается определенное количество реагента, которое добавляется к единице объем.
Влияние на процесс коагуляции содержание в воде естественной взвеси. По своей структуре хлопья Al(OH)3 – это цепочки Al(OH)3 на поверхности которых адсорбированы коллоидные и мелкодисперсные примеси. Эти цепочки могут прилипать к поверхности грубодисперсных примесей, которые является центрами коагуляции. При этом формирование более крупные и плотные хлопья, выпадающие в осадок.
Влияние анионного состава воды проявляется в том, что в зависимости от него изменяется структура и толщина диффузного слоя Б. Анионный состав воды оказывает существенное влияние на электролитное коагулирование Ме(ОН)3 при гидролизе.
Влияние рН или активная реакция среды 
 При рН<4,5 гидролиз Al2(SO4)3 не заканчивается образованием Al(OH)3, т.к. образуются растворимые основные соли.
При рН<4,5 гидролиз Al2(SO4)3 не заканчивается образованием Al(OH)3, т.к. образуются растворимые основные соли.
При рН<8,5 амфотерный гидроксид Al растворяется в следствии образования алюминатов.
При различных значениях рН содержание ионов Al3+, Fe3+ или в общем Ме3+ в растворе по следующей формуле 
|
|
|


